関節リウマチ原因タンパク質のリガンド認識機構の解明に成功(プレスリリース)
- 公開日
- 2006年04月03日
- BL38B1(構造生物学III)
平成18年4月3日
公立大学法人 横浜市立大学
(財)高輝度光科学研究センター
本研究成果のポイント
● 関節リウマチ原因タンパク質PAD4とそのリガンド(ヒストンのアミノ末端(N末端)尾部)との相互作用が原子レベルで詳細に明らかにされた。
● 新しいタンパク質の翻訳後修飾であるシトルリン化と真核生物の転写調節に関する構造科学的知見が初めて得られた。
● 難治性の自己免疫疾患である関節リウマチについて、発症メカニズムに基づいた根本的な治療薬開発に大きく貢献する研究成果が得られた。
|
横浜市立大学国際総合科学研究科の佐藤衛教授の研究グループ(有田恭平学術振興会特別研究員、清水敏之準教授、橋本博助手、日高雄二近畿大学助教授、山田道之教授)は大型放射光施設(SPring-8)及びPF(Photon Factory)の強力な放射光X線を用いて、関節リウマチの原因タンパク質であるペプチジルアルギニン・デイミナーゼ4(PAD4)のリガンド認識機構の解明に世界で初めて成功しました。 (論文) |
1.研究の背景
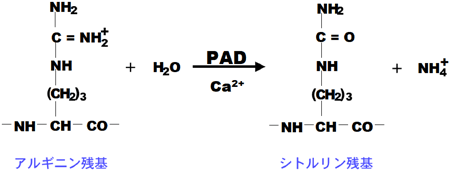
ペプチジルアルギニン・デイミナーゼ4(Peptidylarginine deiminase, PAD)は、Ca2+依存的にアルギニン残基をシトルリン残基に変換する反応を触媒するタンパク質修飾酵素である(図1)。タンパク質のシトルリン化は電荷分布を大きく変化させるので、基質であるターゲットタンパク質の高次構造や、ターゲットタンパク質との相互作用が変化し、細胞内の様々な機能に大きな影響を及ぼす。PADは脊椎動物で発現しており、ヒトでは5種類のタイプ(PAD1–PAD4とPAD6)が存在し、主に細胞の分化に関与している。このうちPAD4は、663アミノ酸残基からなり、核移行シグナル*を持ち、5種類のPADの中で唯一核内に優先的に局在する。
PAD4はヒストンH3の2, 8, 17, 26番目とヒストンH4の3番目のアルギニンをシトルリン化する。ヒストンH3のアルギニン17 (H3/R17) とヒストンH4のアルギニン3 (H4/R3) がメチル化されると、エストロゲンレセプター*を介した転写が活性化されるが、同部位がPAD4によってシトルリン化されると、エストロゲン応答遺伝子の転写が抑制されることがわかっている。このようにPAD4によるヒストンのシトルリン化は遺伝子発現の調節と密接に関係しており、新規のエピジェネティックマーカー*として機能していることが示唆されている。
また、タンパク質のシトルリン化は関節リウマチと深い関連がある。関節リウマチの患部である関節の滑膜では、関節リウマチに特異性の高い自己抗体*が産出されているが、いずれの抗体もPADによってシトルリン化されたタンパク質を非自己 (自己抗原*) として認識して産生されていることが明らかになっている。また、近年のヒトの全ゲノムを対象にした関節リウマチ関連遺伝子の大規模ケースコントロール関連解析*から、PAD4遺伝子上に関節リウマチ感受性の一塩基多型*が見つかった。この関節リウマチ感受性の一塩基多型はPAD4のmRNAの安定化に寄与し、その結果、関節リウマチ患部にPAD4が大量発現すると考えられ、PAD4が関節リウマチの発症および慢性化に深く関与していることが示唆されている。このことから、PAD4の活性阻害剤は関節リウマチの根本的な治療薬になるものと期待される。
以上のようなことから、本研究では、PAD4によるヒストン認識機構、関節リウマチの新規薬剤開発の構造科学的基盤を得ることを目的に、PAD4と3種類のヒストンアミノ末端(N末端)ペプチド(図2)との複合体の立体構造を大型放射光施設SPring-8及びPFの強力な放射光X線を用いて解析した。
2.研究成果
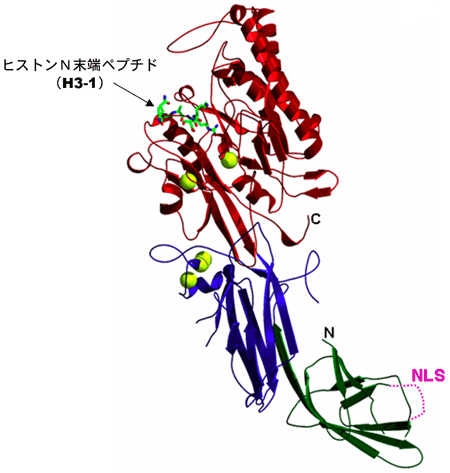
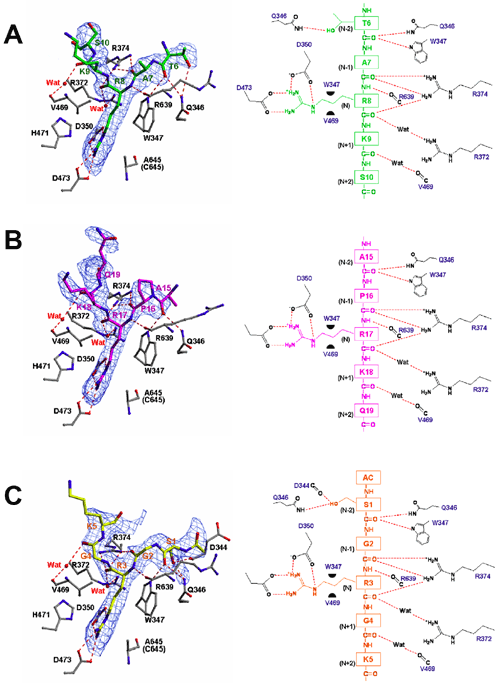
図3にPAD4−ヒストンN末端ペプチド(H3-1)複合体の構造(リボン図)を、そして、図4にPAD4による3種類のヒストンN末端ペプチドの認識機構を示す。PAD4のターゲットとなるアルギニンの位置をNとし、そのアミノ末端の残基をN-1, N-2、カルボキシ末端側をN+1, N+2で表すと、いずれのPAD4-ヒストンペプチド複合体においてもN-2からN+2の5残基のアミノ酸が明瞭に確認された。PAD4はそれぞれのペプチドのN-2からN+1の残基の主鎖と水素結合を形成し、アミノ酸残基の側鎖との相互作用はターゲットのアルギニン残基とN-2の位置の側鎖のみであった。
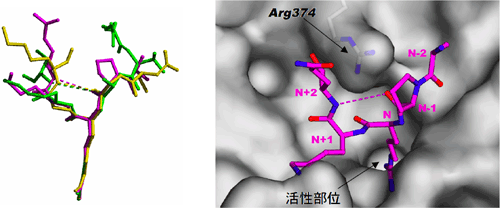
認識されているヒストンペプチドの構造を比較すると、いずれのペプチド鎖も折れ曲がったベータターン*様の構造をとっていて、その構造は互いに非常によく一致していた(図5左)。このようなベータターン様の屈曲構造の形成には活性部位近傍の表面構造と374番目のアルギニン残基とヒストンペプチドとの間の多数の水素結合が大きく寄与していた(図5右)。このベータターン様の構造形成によってペプチドのN-1の主鎖のカルボニル酸素とN+2の主鎖の窒素原子とが同じペプチド内で相互作用できるようになり、PAD4と直接相互作用していないN+2のアミノ酸残基が確認できたものと思われる。
3.展望
最近になって、核内におけるヒストンのシトルリン化が真核生物の転写調節にきわめて重要な役割を果たしていることが明らかにされ、新たなタンパク質の翻訳後修飾*としてヒストン尾部に存在するアルギニン残基のシトルリン化に注目が集まっている。本研究では、PAD4はヒストンのN末端領域と相互作用することによって、柔軟性の高いヒストンN末端尾部にベータターン様の屈曲構造を誘起することがわかり、これまで見つかっていなかったまったく新しいヒストン認識の仕組みを明らかにすることに成功した。さらに、PAD4によるヒストン認識がヒストンペプチドの主鎖部分を介して行われていることが示され、なぜPAD4がヒストンのN末端尾部の複数のアルギニン残基をシトルリン化できるかなども構造科学的に明らかにでき、真核生物の転写調節におけるヒストンのシトルリン化に関して、初めて基礎的な構造科学的知見を与えることができた。
さらに、PAD4の活性阻害剤は関節リウマチの発症メカニズムに基づいた根本的な治療薬になる可能性が高いので、本研究成果によって、関節リウマチの効率的・高選択的な新規薬剤開発が飛躍的に進展するものと期待されます。
<参考資料>
ペプチドH3-1:ヒストンH3の(Lys4からGly13)
ペプチドH3-2:ヒストンH3の(Lys14からLys23)
ペプチドH4:ヒストンH4の(Ser1からLeu10)。
Acはアセチル化。青色と赤色の5残基がPAD4によって認識されて、赤色のアルギニン残基(Arg)がシトルリン化される。
黄色丸はカルシウムイオン(Ca2+)。NLSは核移行シグナルで、この領域はディスオーダーしていた。
A, B, CはそれぞれペプチドH3-1(緑)、H3-2(赤紫)、H4(黄色)の認識部位。
PAD4による活性部位(Active site)近傍の分子表面におけるヒストンN末端ペプチドの認識(右)
ヒストンN末端ペプチドの色は図4と同じ。点線はペプチドのN-1の主鎖のカルボニル酸素とN+2の主鎖の窒素原子との相互作用を示している。
<用語解説>
(1) 核移行シグナル(nuclear localization signal, NLS)
細胞核の中で働くタンパク質(核内タンパク質)が細胞質のリボゾームで合成された後、核内に選択的に輸送されるために必要なアミノ酸配列で、核内に輸送されるためのシグナル(荷札)の役割を果たしている。
(2) ヒストンおよびヒストンN末端尾部
ヒストンとは真核生物の核内に存在して、染色体DNAにイオン的な相互作用で強く結合している一群の塩基性タンパク質。DNAとヒストンの複合体の全体はクロマチンと呼ばれる。そこには5種類のヒストン[H1, H2A, H2B, H3, H4]が存在している。クロマチン中には、(H3)2(H4)2の四量体1つと(H2A–H2B)の二量体2つから成るヒストン八量体に約150塩基対のDNAが巻きついたヌクレオソームコア粒子が繰り返し存在し、ヒストンH1の一部が結合したリンカーDNA(約50塩基対)によって結び付けられている。ヒストン八量体を形成している4種類のヒストン(H2A, H2B, H3, H4)のN末端領域はヒストンN末端尾部と呼ばれ、決まった立体構造をとらないでヌクレオソームコア粒子から突き出ているため、特定部位のアミン酸残基がアセチル化、メチル化、リン酸化、ユビキチン化などの化学修飾を受ける。このような化学修飾は特定の制御因子によって認識され、クロマチンの構造変換を引き起こして遺伝子発現を制御しているので、このような特異的な部位の化学修飾の組み合わせが暗号(コード)を構成するというヒストンコード説が提唱されている。
(3) エストロゲンレセプター
エストロゲン(卵巣においてコレステロールから合成・分泌されるステロイドホルモン)は疎水性の分子で、容易に細胞膜を通過して細胞内に拡散し、特異性のきわめて高いレセプター(エストロゲンレセプター)と結合して特定の遺伝子発現を調節する。
(4) エピジェネティックマーカー
個体発生の過程において親から受け継いだ塩基配列を維持しながら遺伝子発現を変化させるマーカー。このような遺伝子発現の変化と安定性の両面を保証するのがエピジェネティックな調節で、おもにゲノムの化学的な修飾や構造変換によってなされる。
(5) 自己抗体と自己抗原
T細胞(Tリンパ球)は異物(抗原)が自己(自分自身の細胞)か非自己(自分でない異物)かを識別し、異物(抗原)が非自己の場合、T細胞はB細胞に武器(抗体)を作らせて攻撃し、異物を撃退する。しかし、この仕組みに狂いが生じて、自分自身の体の細胞を非自己と認識して(自己抗原)、B細胞に武器(自己抗体)を作らせて攻撃してしまうことがある。このような仕組みの異常でおこる病気が「自己免疫疾患」である。関節リウマチも自己免疫疾患の一つで、タンパク質のシトルリン化によって異物撃退の仕組みに狂いが生じ、自己のタンパク質にもかかわらずシトルリン化によって非自己と認識されて自己抗体が産生される。
(6) ケースコントロール関連解析
関節リウマチの場合、関節リウマチの方とそうでない方との間で一塩基多型に差があるかないかを比較解析する方法。
(7) 一塩基多型(Single nucleotide polymorphisms, SNPs)
遺伝情報はDNAの塩基配列に書かれている。遺伝情報はすべての人がみな同じではなく、個人ごとに違っている部分がある。個人ごとの違いは「遺伝子多型」と呼ばれるが、多型にはいろいろな種類があり、1個の塩基の違いは一塩基多型と呼ばれる。
(8) ベータターン
球状タンパク質でみられるポリペプチド鎖の折り返し構造で、連続する3つのアミノ酸残基からなるペプチド単位で、OiとNi+3の間に水素結合が形成される構造をベータターンという。
(9) タンパク質の翻訳後修飾
リボゾームでタンパク質が合成された後、成熟タンパク質になる過程で受ける種々の化学修飾。真核生物の転写は、ヒストンのN末端尾部のメチル化、アセチル化、リン酸化、ユビチキン化などの翻訳後修飾によって調節されている。
|
<本研究に関する問い合わせ先> 横浜市立大学大学院国際総合科学研究科 <SPring-8についての問い合わせ先> 財団法人高輝度光科学研究センター 広報室 |
- 現在の記事
- 関節リウマチ原因タンパク質のリガンド認識機構の解明に成功(プレスリリース)