Topic 8 放射光SAXSによる超分子集合体の構造解析
「薬物送達システム」を実現するナノ粒子の正体を解明する
医薬品などの薬物を体内の効果を発揮させたい部位に的確に運ぶ技術は「薬物送達システム」あるいは「ドラッグデリバリーシステム(DDS)」と呼ばれる。薬物を生体内の標的部位へ時間的な制御をしながら送達するDDSは、医薬品の効果を高めるとともに副作用を低減し、安全な薬物治療システムを確立するために今もっとも注目されるテーマだ。このDDSも中心となるのはナノテクノロジーである。微量の薬剤を包み込み、毛細血管や細胞の微小な穴を通り抜けることができる超微細なカプセルとなるナノ粒子を使いこなさねばならないからだ。そのためにはナノ粒子の構造を十分に把握する必要があり、ナノ粒子を知るためにもSPring-8の解析能力が活用された。
ナノ粒子の挙動を精密に解析する
DDSを高度に実現するためには、数十から数百nm(ナノメートル=10-9 m)のカプセルを開発し、ここに超微量の薬剤を内包し、細胞や毛細血管の微細な穴を通過させ、患部に到達させねばならない。次世代DDSを実現するためのナノ粒子の多くの候補の中でも有望株と目されているのが高分子ミセルや脂質でつくるミセルである。
ではミセルとは何か。例えば、石鹸をはじめとする界面活性剤は裁縫に使われる待ち針のような形状をしている。針先の部分は、油になじむ「親油基」、あるいは「疎水基」であり、針の頭の部分は水になじむので「親水基」である。このような形状の物質の集合体を水に溶かし、ある濃度以上にすると親水基が外に向き、疎水基が内に向いて会合する。会合とは、同種の分子が2個以上結合し、あたかも1つの分子のようなまとまりを見せる現象だ。このように疎水基と親水基をもつ物質が複数集まって、疎水基が内側を向き、親水基が外側を向いた構造をミセル構造という。疎水基と親水基を分子内に多数含む高分子がつくるミセル構造は、外殻(shell)が親水性連鎖、内核(core)が疎水性連鎖という二重構造を呈する。
ミセルは濃度などの調整を適切に行えば自律的に粒子を構成し、その内核に薬物を封入することができる。しかも粒径は10〜100 nmで、毛細血管の壁をすり抜けることも可能だ。ナノDDS粒子に必要な機能である。
もちろん高分子ミセルなどのナノ粒子でDDSを実現するには、さまざまなハードルがある。例えば、患部のみに薬剤を送達する標的性や患部に達した薬剤の放出を精密に制御する制御性などを実現するのは至難の業である。こうしたハードルを越えるには、ナノ粒子が溶液中でどのような内部構造を示すのか、さらに薬理効果との相関関係はどのようなものなのかなどを正確に把握する必要がある。
ナノDDS粒子の分子設計の技法を確立することを目指してきた北九州市立大学の櫻井和朗教授らの研究グループは「ナノ界面」に注目した。「高分子ミセルなどのナノ粒子の機能や構造は、ナノ界面上の外殻と内核の相互作用に支配されています。ナノDDS粒子開発には、粒子の内部構造、粒子内の親水・疎水界面における薬物の挙動と形態、生体膜との融合の様子を精密に解明する必要があるのです」と櫻井教授は語る。外殻と内核の境界部分がどのような状態なのかを調べなくては始まらないということだ。
高分子ミセルに内包された薬剤の状態を知る
そこで、ナノ界面をSPring-8の構造生物学IIビームラインBL40B2で調べることにより、ミセルの構造を解明するという企てが開始された。この課題は、2008年10月には科学技術振興機構(JST)の戦略的創造研究推進事業(CREST)のプログラムに採択されている。
ナノサイズの生体分子やその集合体の実態を把握する唯一の計測法が「X線小角散乱(SAXS)」だ。X線を照射した場合、角度の小さい散乱は、試料の1 nm〜1 μmサイズの構造の情報を示す。SAXSはこれらのサイズを検知し、形態を画像化する技術である。ただし得られるデータが微弱なため、有効な情報を得るには、測定濃度を生体内の濃度の100倍以上高くする必要があった。これでは測定された構造は試料の生体条件下での構造と大きく異なってしまう。
濃度をここまで高くせざるをえない最大の理由は、寄生散乱にある。寄生散乱は、X線照射によって試料の周辺の空気から発生する光学的な「雑音」である。「粒子の濃度を生体条件に合わせて極限まで低くした超希薄溶液からの測定を行うためには、寄生散乱を取り除く必要がありました」と櫻井教授は実験の経緯を説明する。そのために、水溶液試料をまず自作の密封セルに入れ、それを真空チャンバーに入れて測定する装置が開発された。これによって、寄生散乱などの雑音(ノイズ:N)に対する有効データ(シグナル:S)の比率(S/N比)を飛躍的に高めることに成功した(図1)。もちろんこれを可能にするには、BL40B2や理研構造生物学IビームラインBL45XUの高輝度X線が不可欠である。
研究グループが、まず試料としたのは、ポリエチレングリコール/ポリアスパラギン酸ブロック共重合体(PEG/PAA) に合成レチノイドのひとつであるLE540を内包したものである。レチノイド(レチノレン酸)は制癌作用など多様な生理活性をもつ物質として注目を集め、さまざまな合成レチノイドが研究されている。PEGを外殻とし、PAAを内核とする高分子ミセルでこれを包んだ試料である。「高分子ミセルは制癌剤のDDSとして臨床試験が進んでいますが、内核に内包された薬剤の状態を詳細に調べた例はないのです」と櫻井教授。
そこで試料を超希薄状態で密封セルに入れて、真空チャンバー内に置き、SAXS解析が開始された。するとLE540の添加によって内核のアスパラギン酸の結晶構造が崩れアモルファス(非晶質)になることが判明した。通常の状態でのLE540添加では、この変化は起きないので、半径6 nmといった微小空間での現象であると推定された。この結果は最近、アメリカ化学会の学術誌『Langmuir』に発表された。
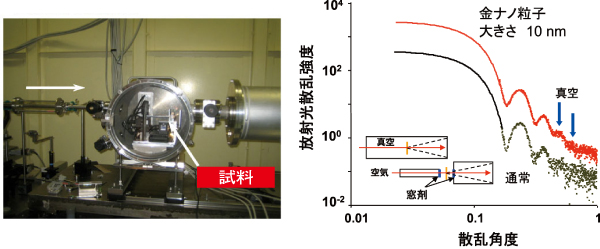
左が真空チャンバー。溶液セルからの散乱を真空で測定する装置。最大6サンプルまでを入れることができ、外部から自動制御で位置や透過光強度を測定することが可能である。その装置で測定した、金コロイド(10 nm)の溶液からの散乱。従来(通常)のセットアップと比較して、青い矢印のところでおよそ10倍ノイズが低減している。
遺伝子導入剤の発現効率を左右する要因
さらに脂質のミセルからなる遺伝子導入剤を試料とした解析も行われた。遺伝子導入剤とは、DNAを取り込み、患部の細胞の遺伝子にこれを導入し、治療を行う技術で、アレルギーをはじめ「体質」に起因する症状への治療効果が期待できる。この遺伝子導入剤もナノDDS粒子の活用分野である。
櫻井教授たちは、遺伝子導入剤の組成と遺伝子導入効率との関係をSAXSによって調べた。標的細胞にDNAが取り込まれる確率に遺伝子導入剤の組成がどのような影響を与えるかの解析である。カチオン性脂質であるベンジルアミン誘導体(BA)に中性脂質のDOPEとDLPCをさまざまな割合で混合し、溶解性と生体親和性を変化させながら遺伝子導入効率を調べた。その結果、導入効率が高い遺伝子導入剤(図3Aの組成)は、DNA添加前から六角柱型(6方晶シリンダー構造)であり、DNA添加後にはその構造の規則性が増していった。これに対してまったく導入効果のない遺伝子導入剤(図3Bの組成)は、DNA添加前には球状ミセルの形状であり、添加とともに6方晶シリンダー構造になるが、やがてラメラ構造に転移した。ラメラとは、親水相と疎水相が層状に重なった構造である。「導入効率の高い例でDNAは親水相に取り込まれ(図2A)、低い例でDNAは疎水相に取り込まれており(図2B)、この差が発現効率を決めているのだろうと私たちは考えました」と櫻井教授。このように遺伝子導入剤は中性脂質の存在の仕方で遺伝子の導入効率が大きく異なり、それはミセルの構造と関係している。「それまで不可能だったナノ粒子の可視化によって、ナノDDS実現に大きく近づくことができました」と櫻井教授は語る。
こうした一連の研究成果や、多糖を用いたDDSの研究によって櫻井教授は2008年度高分子学会三菱化学賞を受賞した。ナノDDS粒子の研究が、高分子科学分野での基礎技術であり、かつ産業に寄与する業績であることを高分子学会が賞したのである。
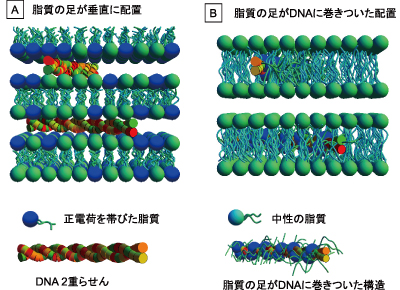
A:カチオン性脂質がつくる2分子膜の頭部にDNAが挟まれ、親水相に存在するモデル。主にSofinyaらが提唱。B:DNAに巻きついた脂質のアルキル鎖がDNAを疎水的にして、それが2分子膜の疎水相に取り込まれたモデル。Bloomfieldらが提唱。
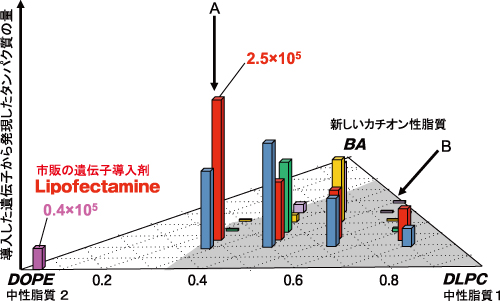
3角相図で示した、脂質の混合組成と遺伝子発現効率(縦軸)の関係。平面座標でベンジルアミン誘導体(BA)と中性脂質のDLPC、DOPEの比率を示している。発現効率がもっとも高いAは、BA:DOPE:DLPC=1:2:1、発現のほとんど見られないBは、BA:DLPC=1:1という組成であり、図2のAとBに対応していると考えている。