DNA光回復酵素のFAD光還元反応を XFEL時分割構造解析にて解明(プレスリリース)
- 公開日
- 2022年04月28日
- SACLA BL2
2022年4月28日
台湾中央研究院
高輝度光科学研究センター
ドイツ・フィリップ大学マールブルク
大阪大学
京都大学
【発表のポイント】
・DNA紫外線損傷ピリミジン二量体を修復するDNA光回復酵素(DNAフォトリアーゼ)が修復に先立って光還元される反応機構を解明した。
・DNA光回復酵素に内包されるフラビン補酵素(FAD)※1が二段階に光還元され、その中間段階として「バタフライツイスト」の形状を経由することが発見された。
・生命基本原材料のFAD分子の反応中間体の構造が明らかになり、多くのフラビン酵素で合理的に触媒を設計するための第一歩が踏み出された。
台湾中央研究院・生物化學研究所のManuel Maestre-Reyna客座助理教授、別所義隆客座教授、蔡明道特聘研究員らは、ドイツ・フィリップ大学マールブルクのLars-Oliver Essen教授、大阪大学大学院基礎工学研究科の山元淳平准教授、公益財団法人高輝度光科学研究センターの登野健介主席研究員、理化学研究所の南後恵理子チームリーダー(現東北大学教授)、京都大学の岩田想教授、及び台北醫學大學、ヘブライ大学、サンニオ大学、グルノーブル・アルプ大学、欧州シンクロトロン放射光研究所の研究者らとの国際共同研究で、X線自由電子レーザー(XFEL)※2施設SACLA※3のBL2ビームラインを用いて、DNA紫外線損傷を修復するDNA光回復酵素の光還元反応時における動的構造を、時分割結晶構造解析にて初めて解明しました。フラビン補酵素FADの酸化還元活性に必要な電子およびプロトン移動の動的制御を、ナノ秒のスケールで見出しました。 本研究成果は、2022年4月7日付けで、「Nature Chemistry」誌にオンライン掲載されました。 【論文情報】 |
【研究の背景】
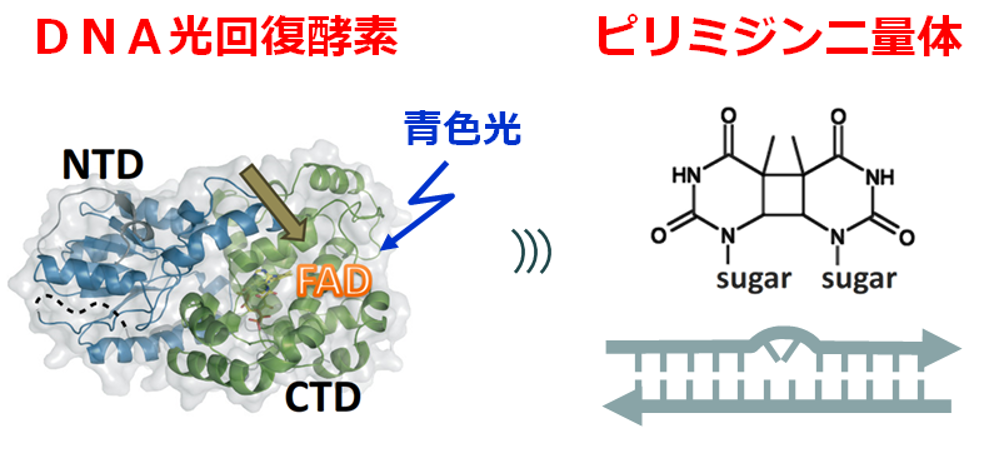
DNA光回復酵素は、紫外線曝露により生じるDNAピリミジン二量体の損傷を修復する酵素です(図1)。この酵素は、反応に青色の光を必要としており、酵素の反応中心にあるフラビン補酵素(FAD)がフォトンを捉えると、近傍のアミノ酸残基から電子を受け取ったのち、1回目の反応サイクルで酸化型(FADox)からアニオン性セミキノン型(FAD・-)を経て中性セミキノン型(FADH・)に、2回目の反応サイクルで還元型(FADH-)に変化し、酵素によるDNA修復の準備が完了します。この反応は、光還元反応と呼ばれています。このたび、国際研究グループが、DNA光回復酵素の光還元反応における反応中間体の立体構造を、原子レベルの分解能で決定することに初めて成功しました。
【研究内容と成果】
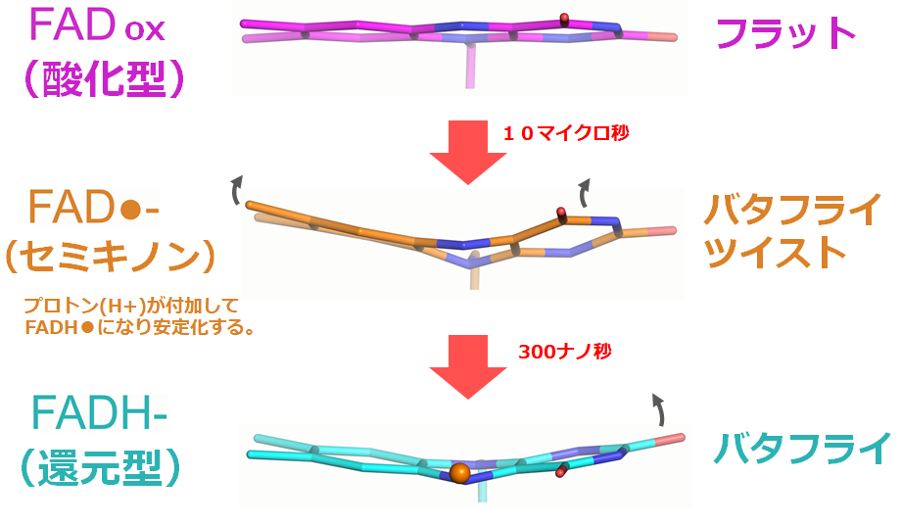
還元や酸化など、あらゆる化学反応では、反応物が生成物に変化します。この遷移の経路と、そこに存在する反応中間体の物質状態の解明が、現代化学の中核となっています。しかし、多くの化学反応はナノ秒からミリ秒オーダーの非常に速い反応なので、反応中間体の研究は非常に難しく、その性質についてはごく限られた情報しか得られていないのが現状です。ここで、研究グループは、SACLAでのXFEL時分解構造解析により、古細菌のDNA光回復酵素をターゲットに、光還元反応における10ナノ秒から5ミリ秒までの異なる時間のスナップショットを集め、複数の酸化還元状態のFADとそれを支えるタンパク質のアミノ酸側鎖の動的変化を3D動画として作成しました。
この3D動画では、酸化型と中性セミキノン型の2種類の酵素を時分割実験の出発材料として準備することで、それぞれのサイクルで時々刻々と変化する補酵素FADおよびタンパク質の様子を捉えました(図2)。青色光によって光還元反応が始まった後、平坦な形状であるFADoxがナノ秒以内に歪んだ形状へと変化し、まるで蝶の羽ばたきのように動きます。さらに、補酵素の近くにあるアミノ酸残基がこのFADの動きを安定化させ、強いねじれを特徴とする最初の半安定中間体であるアニオン性セミキノン型(FAD・-)へと変化することが見出されました。これは「バタフライツイスト」と名付けられた構造で、今回初めて発見されました。「FAD・-」はプロトン(H+)を供与されて中性セミキノン型(FADH・)となり、さらに2回目の光還元反応によって「バタフライ型」の構造を持つ最終生成物である還元型FADH-へと変化する過程も観測することに成功しました。
【今後の展開】
フラビン補酵素(FAD)は、全ての生命に必須の基本補酵素です。本研究は、化学反応における反応中間体の性質や構造を経時的に詳細に解析することで、基礎化学の理解に大きく貢献するものです。さらに、反応物でも生成物でもなく、「反応中間体」という酵素の真の活性状態に基づいて合理的に触媒を設計するための第一歩となるものです。
台湾中央研究院のプレスリリース(3D動画もポストされています)
http://tpp.ibc.sinica.edu.tw/en-paper-20220407.php
図1. 光回復酵素による紫外線損傷DNAの修復
図2. フラビン補酵素(FAD)の光還元反応
【用語解説】
※1. FAD
フラビンアデニンジヌクレオチドFlavin Adenine Dinucleotideの略称。ビタミンB2(リボフラビン)にオルトリン酸が2分子とアデノシン1分子が結合した化合物で,多くの酸化還元酵素の補酵素として重要である。アデノシンが結合しないフラビンモノヌクレオチド(FMN)とともに、フラビン補酵素と呼ばれる。両者は、微生物から高等動物まで広く生命基本原材料として細胞内反応に使われている。酸化型、アニオン性セミキノン型、中性セミキノン型、還元型の状態を示すために、それぞれ「FADox」、「FAD・-」、「FADH・」、「FADH-」と表記した。
※2. X線自由電子レーザー(XFEL)
近年の加速器技術の発展によって実現したX線領域のパルスレーザー。従来の半導体や気体を発振媒体とするレーザーとは異なり、真空中を高速で移動する電子ビームを媒体とするため、原理的な波長の制限はない。SPring-8などの従来の放射光源と比較して、10億倍も高い輝度のX線がフェムト秒(1,000兆分の1秒)スケールの時間幅を持つパルス光として出射される。この高い輝度を活かしてマイクロメートルサイズの小さな結晶を用いたタンパク質の原子分解能の構造解析やX線領域の非線形光学現象の解明などの用途に用いられている。
※3. SACLA
理化学研究所と高輝度光科学研究センターが共同で建設した日本ではじめてのXFEL施設。高い空間コヒーレンス、短いパルス幅、高いピーク輝度を備えたX線領域のレーザーを発生させる。2011年3月に施設が完成し、SPring-8 Angstrom Compact free electron LAserの頭文字を取ってSACLAと命名された。2011年6月に最初のX線レーザーを発振、2012年3月から共用運転が開始され、利用実験が始まった。大きさが諸外国の同様の施設と比べて数分の1とコンパクトであるにもかかわらず、0.1 nm以下という世界最短クラスの波長のレーザー生成能力を持つ。
【本件に関する問い合わせ先】 |
- 現在の記事
- DNA光回復酵素のFAD光還元反応を XFEL時分割構造解析にて解明(プレスリリース)
 sinica.edu.tw または bessho
sinica.edu.tw または bessho