X線自由電子レーザーで捉えたビフィズス菌酵素の常温構造 -局所的な構造変化から示唆された酵素反応メカニズム-(プレスリリース)
- 公開日
- 2023年04月10日
- SACLA
2023年4月10日
理化学研究所
京都大学
東北大学
高輝度光科学研究センター
|
理化学研究所(理研)放射光科学研究センター利用技術開拓研究部門SACLA利用技術開拓グループの岩田想グループディレクター(京都大学大学院医学研究科教授)、分子動画研究チームの南後恵理子チームリーダー(東北大学多元物質科学研究所教授)、高輝度光科学研究センターXFEL利用研究推進室先端光源利用研究グループ実験技術開発チームの登野健介チームリーダーらの共同研究グループは、ビフィズス菌の解糖系[1]酵素の立体構造を常温下で決定し、その酵素の反応メカニズムに関する新たな知見を見いだしました。 論文情報 |
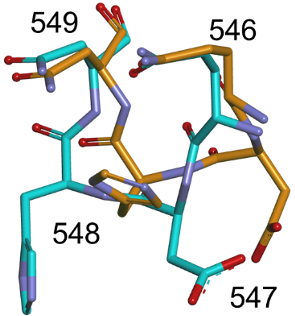
構造変化が観測されたQNループ構造(常温構造はオレンジ色、極低温構造は水色で示す)
背景
生体内には、酵素と呼ばれる特定の物質を別の物質に変換する機能を持つタンパク質が数多く存在しています。これらの酵素群が共同してさまざまな物質やエネルギーを合成することにより、複雑な生命現象が機能しています。
酵素の反応メカニズムを理解する上で、その形状(立体構造)は重要な情報となります。有用物質を効率的に合成できる特性から、酵素は古くから工業生産に利用されています。その際には、対象酵素を高機能化する必要性がしばしば生じます。こうした高機能化酵素を設計する上でも、その立体構造情報は重要です。
近年では、酵素の立体構造はX線結晶構造解析[7]やクライオ電子顕微鏡[8]によって解析されていますが、これらの手法で得られるのは、放射線損傷[9]を減じるために、もっぱら−170℃付近の極低温で測定された構造(極低温構造)です。従来、この極低温への冷却はタンパク質構造にわずかな影響しか引き起こさないとされてきました。しかし近年の研究により、タンパク質の機能的に重要な可動領域は極低温の影響を特に受けやすく、バイアスのかかった構造を見てしまう可能性があることが示されています。
X線自由電子レーザー(XFEL)施設「SACLA」では、連続フェムト秒結晶構造解析(SFX)法により、常温のタンパク質の構造(常温構造)を基本的には放射線損傷の影響を受けることなく観測することができます。そこで本研究では、ビフィズス菌の解糖系酵素であるホスホケトラーゼをターゲットとして、常温構造解析の有用性を見極め、また対象酵素の反応メカニズムに対して新たな知見を得るべく、SACLAにおいてSFX法を実施しました。
研究手法と成果
SFX法を実施するには、数マイクロメートル(µm、1µmは1,000分の1mm)程度の大きさのタンパク質の微小結晶が一定量必要となります。今回のターゲットであるホスホケトラーゼの場合、通常の方法では、タンパク質の凝集物の沈殿が優先的に生じてしまい、微小結晶を効率よく得ることは困難でした。そこで、共同研究グループは光誘起タンパク質結晶化プレート(富士フイルム和光純薬製)を用いて、光を照射しながら結晶化を試みたところ、SFX法の測定に必要な量の微小結晶を短時間で取得できるようになりました(図1)。
図1 光誘起タンパク質結晶化プレートを用いたホスホケトラーゼ微小結晶の調製
(a) 蛍光照射時。25℃で1日間静置した後の写真。数多くの微小結晶の析出が見られた。
(b) 蛍光未照射時。25℃で1週間静置した後の写真。最初に沈殿した大量の凝集物の中から、少量の微小結晶の析出が見られた。
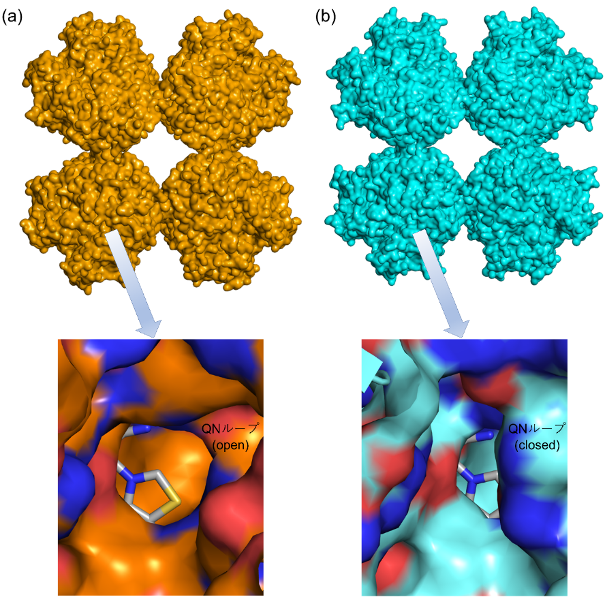
こうして得られた微小結晶を用いて、SFX法によるホスホケトラーゼの常温構造解析を実施しました。その結果、決定された立体構造は分子全体の構造に関しては、以前に解析された極低温構造とほぼ一致していました(図2上)。一方、両構造を詳細に比較すると、546~549番目の4アミノ酸残基から構成されるループに興味深い構造変化が観測されました(冒頭の図)。このループ(QNループ)は、基質が結合するポケットの入り口付近に位置しています(図2下)。極低温構造では、QNループが基質結合ポケットの入り口を狭めていた(closed formコンフォメーション)のに対し、今回SFX法で解析された常温構造では、QNループは逆に入り口を広げていました(open formコンフォメーション)。
図2 ホスホケトラーゼの立体構造
上側は全体構造の図。下側は基質結合ポケット周辺を拡大した図である。下図では、基質結合ポケットの底に補酵素であるチアミン二リン酸(スティック表示)が見える。
(a) XFEL施設「SACLA」でSFX法により解析された常温構造。QNループが基質結合ポケットの入り口を広げている。
(b) 通常のX線結晶構造解析で解析された極低温構造。QNループが基質結合ポケットの入り口を狭めている。
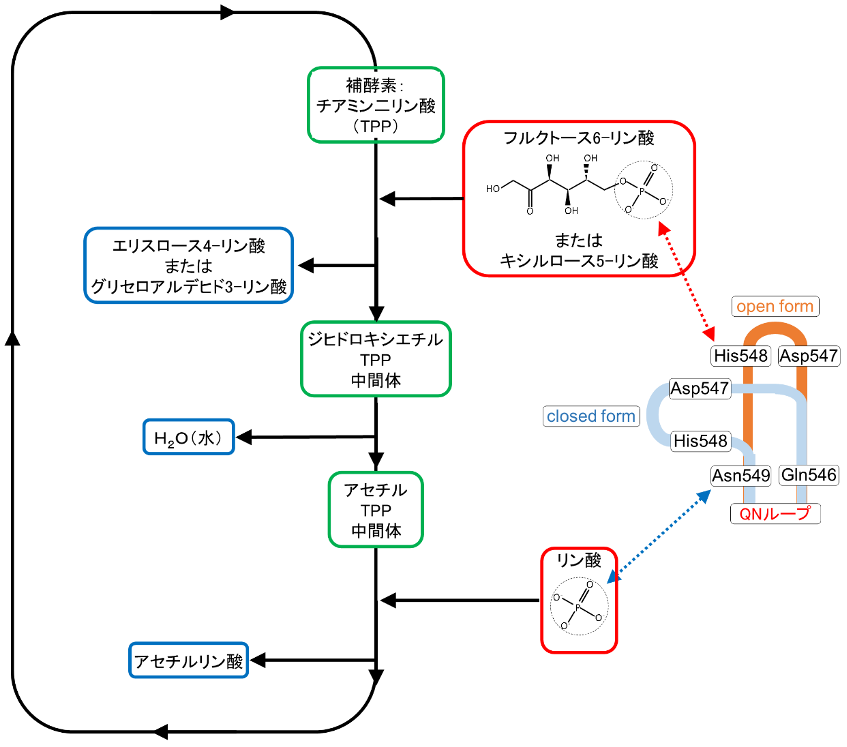
今回同時に解析したホスホケトラーゼと阻害剤の複合体の構造や、過去に解かれた類縁酵素の構造を参考にした結果、QNループの構造変化がホスホケトラーゼの反応メカニズムに関係していることが推定されました(図3)。すなわち、QNループのopen formコンフォメーションは、1番目の基質であるフルクトース6-リン酸(またはキシルロース5-リン酸)がホスホケトラーゼの触媒部位にアクセスできるように機能し、同ループのclosed formコンフォメーションは、2番目の基質をサイズの小さなリン酸に限定する役割を果たしているというメカニズムが示唆されました。
SFX法による常温構造解析が、機能発現に重要な役割を果たすことが多いタンパク質分子の可動領域のダイナミックな構造変化を捉えた結果、得られた知見といえるでしょう。
図3 ホスホケトラーゼの反応メカニズムの模式図
補酵素であるチアミン二リン酸に1番目の基質であるフルクトース6-リン酸が結合し、いくつかの中間体を経て2番目の基質であるリン酸が結合し、最終生成物であるアセチルリン酸が遊離することにより、反応が完了する。今回の解析から推定されたQNループの役割を模式的に追記した。
今後の期待
ホスホケトラーゼの微小結晶の調製に際しては、光誘起タンパク質結晶化プレートの使用が非常に有効でした。一般にタンパク質の微小結晶はタンパク質が凝集しやすい過酷な条件で調製されることが多いため、この結晶化プレートは他のタンパク質の微小結晶調製にも有効である可能性があります。
タンパク質の極低温構造においては、機能的に重要な可動領域がバイアスのかかった構造をとっている場合があることが、近年の研究によって示されていますが、今回の解析により、ホスホケトラーゼについてもその知見が当てはまることが確認されました。今後、SFX法を活用した構造研究を積み重ねることにより、常温・極低温間におけるタンパク質の構造変化のメカニズムの解明がさらに進むと期待できます。
SFX法は放射線損傷の問題を克服し、常温という生理的環境下でのタンパク質構造を解明できる強力な解析法です。こうした方法により、タンパク質立体構造情報の取得や研究が進むと、各タンパク質の機能解明に有用な学術的知見が増大するとともに、ドラッグデザインや酵素の高機能化設計などを通じてタンパク質構造の産業利用がますます進展すると期待できます。
【用語解説】
[1] 解糖系
グルコースをピルビン酸などの有機酸に分解する代謝経路。最も基本的な代謝系の一つ。エムデン-マイヤーホフ経路は最も一般的な解糖系として知られており、ほとんどの真核生物や嫌気性細菌ではこの経路が用いられている。ホスホケトラーゼは、乳酸菌、酵母、カビなど一部の微生物に存在する特殊な解糖系であるビフィドシャント(bifid shunt)で中心的な役割を担う酵素である。
[2] X線自由電子レーザー(XFEL)
X線領域におけるレーザーのこと。従来の半導体や気体を発振媒体とするレーザーとは異なり、真空中を高速で移動する電子ビームを媒体とするため、原理的な波長の制限はない。また、数フェムト秒(1フェムト秒は1,000兆分の1秒)の超短パルスを出力する。XFELはX-ray Free Electron Laserの略。
[3] 「SACLA」
理研と高輝度光科学研究センターが共同で建設した日本で初めてのXFEL施設。2011年3月に施設が完成し、SPring-8 Angstrom Compact free electron LAserの頭文字を取ってSACLAと命名された。コンパクトな施設の規模にもかかわらず、0.1nm以下という世界最短波長クラスのレーザーの生成能力を持つ。
[4] 連続フェムト秒結晶構造解析(SFX)法
多数の微結晶を含む液体などをインジェクター(試料輸送装置)から噴出しながら、X線レーザーを照射し結晶の構造を解析する手法。配向の異なる多数の微結晶からの回折イメージを連続的に収集する。SFXはSerial Femtosecond Crystallographyの略。
[5] ホスホケトラーゼ
チアミン二リン酸(TPP)を補酵素とする酵素群の一種。キシルロース5-リン酸(またはフルクトース6-リン酸)とリン酸からグリセルアルデヒド3-リン酸(またはエリスロース4-リン酸)と水とアセチルリン酸を生成する反応を触媒する酵素(図3を参照)。
[6] 光誘起タンパク質結晶化プレート
ポケット部に金ナノ膜加工を施したタンパク質結晶化プレート。このプレートに光照射を行うと、金ナノ粒子に表面プラズモン共鳴が誘起され、金に吸着していたタンパク質分子の濃縮と配向が進行して、タンパク質結晶の核形成が促進され、結晶化期間の短縮が実現するとされている。群馬大学の奥津教授らにより開発され(Veesler, S., et al., & Okutsu, T. (2006). Cryst. Growth Des. 6, 1631–1635)、富士フイルム和光純薬株式会社(研究当時:和光純薬工業株式会社)から製品化された。
[7] X線結晶構造解析
タンパク質が規則正しく並んだ結晶に、X線を照射すると回折像が得られる。その回折像を解析して、タンパク質の構造を解明する実験手法。タンパク質を構成する個々の原子の位置を決定できる。
[8] クライオ電子顕微鏡
透過型電子顕微鏡の一種。極低温下にサンプルを冷却して観察する。サンプルを結晶化する必要がないため、タンパク質などの生体分子の構造解析に適している。
[9] 放射線損傷
X線の持つエネルギーによって、X線と相互作用した分子が壊れること。X線との相互作用で分子が壊れる場合だけでなく、分子が壊れる過程で生じる電子や、壊れた分子から生成する反応性の高い分子が観察対象の分子と化学反応する場合もある。一般的にタンパク質結晶の放射線損傷は、X線と水の相互作用をきっかけに、X線照射後ピコ秒(1ピコ秒は1兆分の1秒)の時間スケールで、水から生成する反応性の高い分子がタンパク質と化学反応することで起きる。
国際共同研究グループ
| 理化学研究所 放射光科学研究センター | ||||||
| 利用技術開拓研究部門 SACLA利用技術開拓グループ | ||||||
| グループディレクター | 岩田 想 | (イワタ・ソウ) | ||||
| (京都大学大学院 医学研究科 教授) | ||||||
| 分子動画研究チーム | ||||||
| チームリーダー | 南後恵理子 | (ナンゴ・エリコ) | ||||
| (東北大学 多元物質科学研究所 教授) | ||||||
| 利用システム開発研究部門 生物試料基盤グループ | ||||||
| グループディレクター(研究当時) | 国島直樹 | (クニシマ・ナオキ) | ||||
| (理研RSC-リガク連携センター 客員研究員) | ||||||
| 先任研究員(研究当時) | 内藤久志 | (ナイトウ・ヒサシ) | ||||
| (利用技術開拓研究部門 生体機構研究グループ 先任研究員) | ||||||
| リサーチアソシエイト(研究当時) | 松浦祥悟 | (マツウラ・ヨシノリ) | ||||
| 利用システム開発研究部門 物理・化学系ビームライン基盤グループ | ||||||
| グループディレクター | 矢橋牧名 | (ヤバシ・マキナ) | ||||
| 高輝度光科学研究センター | ||||||
| XFEL利用研究推進室 先端光源利用研究グループ 実験技術開発チーム | ||||||
| チームリーダー | 登野健介 | (トノ・ケンスケ) | ||||
| 味の素株式会社 | ||||||
| 研究員(研究当時) | 中田國夫 | (ナカタ・クニオ) | ||||
| 上席研究員(研究当時) | 柏木立己 | (カシワギ・タツキ) | ||||
| グループ長(研究当時) | 水越利巳 | (ミズコシ・トシミ) | ||||
| 理事(研究当時) | 宮野 博 | (ミヤノ・ヒロシ) | ||||
| (エーエス フロンティアーズ代表/東京薬科大学客員教授) | ||||||
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業新学術領域研究(研究領域提案型)「時分割実験のための多様な反応誘起システムの開発」(19H05781、研究代表者:南後恵理子)、「高速分子動画法によるタンパク質非平衡状態構造解析と分子制御への応用」(19H05776、研究代表者:岩田想)、日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業(BINDS)(JP21am0101070、 研究代表者:岩田想)、文部科学省X線自由電子レーザー施設重点戦略課題推進事業(研究代表者:岩田想)による助成を受けて行われました。
発表者・機関窓口 |
- 現在の記事
- X線自由電子レーザーで捉えたビフィズス菌酵素の常温構造 -局所的な構造変化から示唆された酵素反応メカニズム-(プレスリリース)

 ml.riken.jp
ml.riken.jp