タンパク質の形成を助ける「空洞」に蓋がつく過程を捉えた(プレスリリース)
- 公開日
- 2024年03月16日
- クライオ電子顕微鏡(EM01CT)
2024年3月16日
高輝度光科学研究センター
東京大学
発表のポイント
◆シャペロニンは細胞内で多くのタンパク質が正しいかたちをとることを助けるタンパク質です。
◆シャペロニンには蓋のような分子が結合することで内部に隔離された空洞が生まれ、そこでタンパク質の形成を助けます。
◆水素細菌の熱に強いシャペロニンを用いて、高分解能の電子顕微鏡法により、蓋分子が結合してかたちが変化する様子を明らかにしました。
|
シャペロニンというタンパク質は、細胞内で他の多くのタンパク質が正しく折りたたむのを助けることにより生命活動に重要な役割を果たしています。東京大学大学院農学生命科学研究科の廖増威大学院生、荒川孝俊助教(当時)、伏信進矢教授は、同研究科の亀谷将史助教、石井正治教授、理化学研究所のChai C. Gopalasingam特別研究員、Christoph Gerle研究員、高輝度光科学研究センターの重松秀樹研究員と共同で、水素細菌と呼ばれる高熱に強い細菌から得たシャペロニンの立体構造を解明しました。その結果、水素細菌のシャペロニンが大きな複合体を形成する途中の段階として、蓋になる分子が結合して外部から隔離された空間ができあがる様子が明らかになりました。この空間に他のタンパク質を取り込んで保護し、細胞内の他の分子の邪魔を受けずに折りたたみを助けると考えられます。タンパク質の折りたたみに異常が起こると、さまざまな病気になることが知られているため、シャペロニンがどのように作用するのかを明らかにすることはその基礎的な過程を理解するのに役立つと期待されます。 論文情報 |
【研究内容】
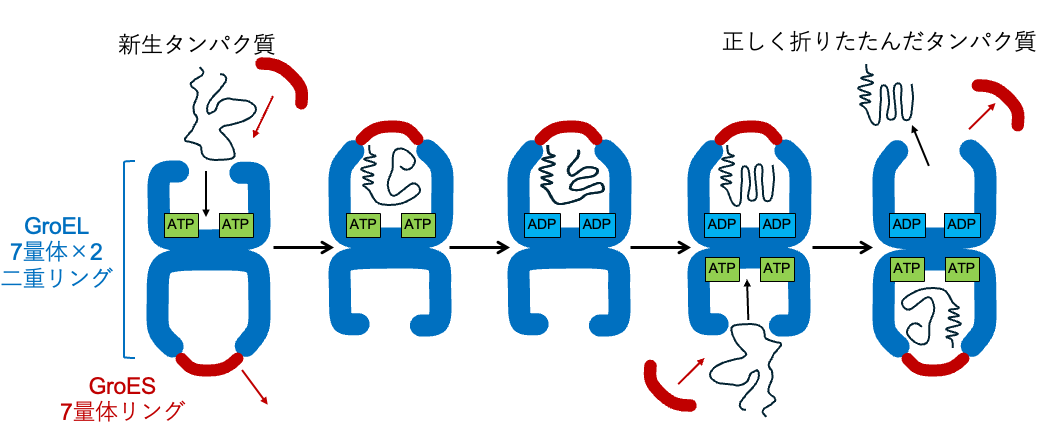
生命活動は、多数のタンパク質の働きの上に成り立っています。タンパク質は多くのアミノ酸が鎖状につながった高分子であり、正しく折りたたむ(フォールディングする)ことで本来の機能を発揮します。しかし、細胞の中は他のタンパク質や高分子で混み合っており、多くのタンパク質はそれらに邪魔されて自発的に正しくフォールディングすることができないので、あらゆる生物には分子シャペロン※1と呼ばれる、正確なフォールディングを助けるタンパク質が存在します。分子シャペロンにはいくつか種類がありますが、シャペロニンはその代表格としてよく知られています。シャペロニンの本体はGroELと呼ばれる14量体の大きな樽のような分子であり、7量体のリングが反対向きに重なった二重リング構造をしています。GroELにはさらにGroESと呼ばれる7量体のリング状の補助分子が結合して複合体を作ることにより、効率的なタンパク質のフォールディングを行います。大腸菌のシャペロニンはよく研究されており、もっぱら弾丸型の状態で存在することで、図1に示したような「交互結合型」の機構で働くことが知られています。GroELに1つのGroESが結合した弾丸型の状態に新生タンパク質※2が結合して、さらに別のGroESが結合して蓋をすることで、外部から隔離されたフォールディングが起こる空洞が生まれます。GroELがATP※3を加水分解することでシャペロニンに動きが生まれ、正しくフォールディングしたタンパク質とGroESが外れるとともに、反対側のGroELにATPと新生タンパク質とGroESが結合することで、交互に生まれる隔離された空洞が他のタンパク質のフォールディングを次々と助けていくモデルが考えられています。しかし、GroELにGroESが結合して解離していく過程はシャペロニンの機能にとって重要であるにもかかわらず、どのようなかたちの変化が起こるのかについて、よく分かっていませんでした。
東京大学大学院農学生命科学研究科の酵素学研究室の廖増威大学院生、荒川孝俊助教(当時)、伏信進矢教授らのグループは、同大学院の応用微生物学研究室で亀谷将史助教、石井正治教授らが研究対象としている水素細菌※4に着目しました。Hydrogenophilus thermoluteolus TH-1株(Hp1)とHydrogenobacter thermophilus TK-6株(Hb6)はいずれも高温の環境で生息する水素細菌であり、熱に強いタンパク質を持っています。廖増威大学院生らはHp1株とHb6株のシャペロニンを用いて、単粒子解析による立体構造を観察しました。データ測定と構造解析は理化学研究所放射光科学研究センターのChai C. Gopalasingam特別研究員、Christoph Gerle研究員および高輝度光科学研究センターの重松秀樹研究員の協力のもとで大型放射光施設SPring-8※5が有するクライオ電子顕微鏡※6装置(CRYO ARM 300/EM01CT)を用いて行われました。
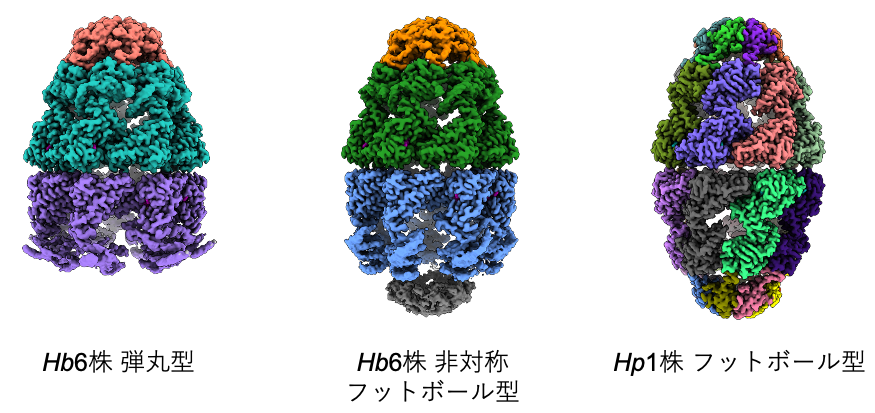
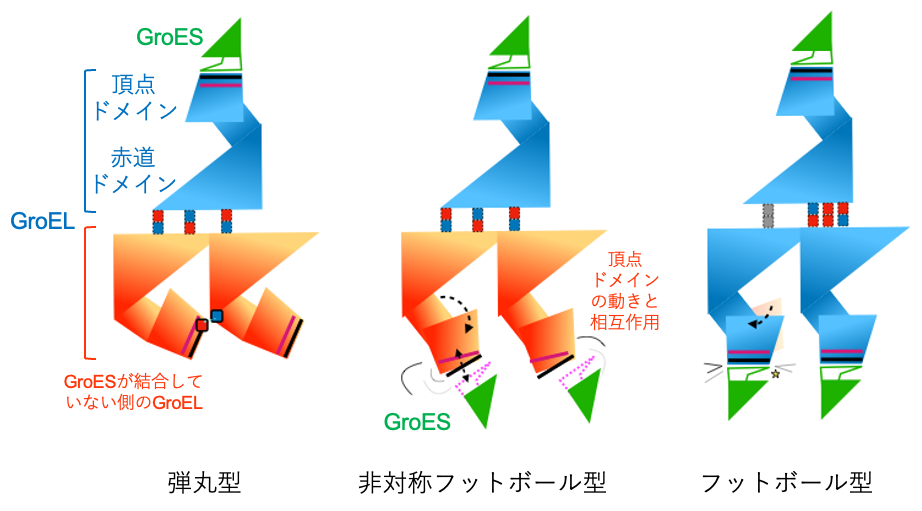
Hp1株のシャペロニンにATPを加えて解析した結果、90%以上の粒子が大腸菌のシャペロニンではほとんど存在しないと考えられているフットボール型の状態で存在することが分かりました(図2右)。一方、Hb6株のシャペロニンにATPの類似化合物(AMP-PNP)を加えて解析すると、弾丸型と、これまでに観察されたことがない非対称フットボール型の状態が混在することが分かりました(図2左および中)。このことは、かつて定説とされていた交互結合型機構だけでは説明できないシャペロニンの作用メカニズムが存在する可能性があることを示しています。また、非対称フットボール型では、GroELがGroESと相互作用する頂点にあたる部分(頂点ドメイン)がやや伸びており、フットボール型で頂点ドメインが完全に伸びた状態との中間にあたる構造を取っていました(図3)。すなわち、非対称フットボール型は、弾丸型にもう1分子のGroESが結合してフットボール型になるまでの「動き」をあらわした状態であると考えられます。
本研究では初めて熱に強いシャペロニンをクライオ電子顕微鏡での観察対象としたため、これまで観察されてこなかった複合体の状態を捉えることに成功したと推測されます。分子シャペロンは細胞内でタンパク質が生まれて壊れていくまでの様々な局面で重要な役割を担っています。分子シャペロンに異常が起こることにより引き起こされるいわゆる「シャペロン病」は多く知られており、高温などのストレスに耐える分子シャペロンの構造原理は注目されていました。さまざまな高分子を収納できる空洞の性質に着目したナノカプセル、分散剤、分子のデリバリーシステムなどの用途も模索されてきました。このような用途において有望な水素細菌の熱に強いシャペロニンのかたちと動きのしくみが分かったことも本研究の重要な成果です。
【参考情報】
図1 大腸菌のシャペロニンで考えられている作用メカニズム
図2 水素細菌のシャペロニンの立体構造
図3 各状態における動きと相互作用
【用語解説】
※1. 分子シャペロン
タンパク質が正しくフォールディングして(折りたたまれて)本来の機能を発揮できるように、その過程を補助するタンパク質。フォールディングを邪魔する細胞内の他の分子から保護するほかにも、間違った折りたたみをほどいたり、タンパク質を組み立てる化学結合が正しく作られるのを補助するなど、さまざまな役割の分子シャペロンが存在する。
※2. 新生タンパク質
リボソームでアミノ酸がつながり、ポリペプチドとして生合成されたばかりの、まだ正しくフォールディングしていない状態のタンパク質。そのタンパク質本来の機能を持たないために、新生ポリペプチドとも呼ばれる。
※3. ATP
アデノシン三リン酸の略。生体のエネルギー通貨として知られており、加水分解されてアデノシン二リン酸(ADP)とリン酸に分かれることにより生じる大きなエネルギーが生合成や分子の動きなど様々な用途に使われる。
※4. 水素細菌
水素を酸化してエネルギー生産を行い、二酸化炭素固定により有機物を合成する化学合成独立栄養生物。Hydrogenophilus thermoluteolus TH-1株とHydrogenobacter thermophilus TK-6株は系統樹上では離れた位置にある水素細菌だが、至適生育温度がそれぞれ52℃と70〜75℃であり、いずれも好熱性の微生物である。
※5. 大型放射光施設SPring-8
理化学研究所が所有する兵庫県の播磨科学公園都市にある世界最高性能クラスの放射光を生み出す大型放射光施設で、利用者支援は高輝度光科学研究センターが行っている。SPring-8の名前はSuper Photon ring-8 GeVに由来。SPring-8では、放射光を用いてナノテクノロジー、バイオテクノロジーや産業利用まで幅広い研究が行われており、そのなかで高輝度のX線を用いた生体高分子用結晶構造解析ビームラインやクライオ電子顕微鏡などの構造生物学だけでなく、様々な測定に用いられる設備を有している。
※6. クライオ電子顕微鏡
氷に埋包して極低温に冷却したタンパク質などの生体分子に電子線を照射して観察する透過型電子顕微鏡(TEM)の一種。撮影した多数の生体分子の粒子像から立体構造を解析する手法は単粒子解析法と呼ばれる。
|
本件に関するお問い合わせ先 |
- 現在の記事
- タンパク質の形成を助ける「空洞」に蓋がつく過程を捉えた(プレスリリース)
 g.ecc.u-tokyo.ac.jp
g.ecc.u-tokyo.ac.jp