働く酵素の姿をミリ秒で捉える ―SACLAが拓く新しい時分割タンパク質構造決定法の可能性―(プレスリリース)
- 公開日
- 2025年12月19日
- SACLA
2025年12月19日
大阪医科薬科大学
大阪大学
東北大学
龍谷大学
大阪公立大学
量子科学技術研究開発機構
神戸大学
理化学研究所
高輝度光科学研究センター
京都大学
兵庫県立大学
研究のポイント
◾️酵素の反応過程をミリ秒レベルで可視化することに成功
◾️独自の二液混合装置による時間分解結晶構造解析で、酵素が構造を変化させる仕組みを解明
◾️新しい時分割タンパク質構造決定法として、生命科学研究の可能性を大きく広げると期待
|
【概要】 本研究は英国科学誌「Nature Communications」に12月18日(木)19時(日本時間)に公開されました。 【論文情報】 |
【研究の内容】
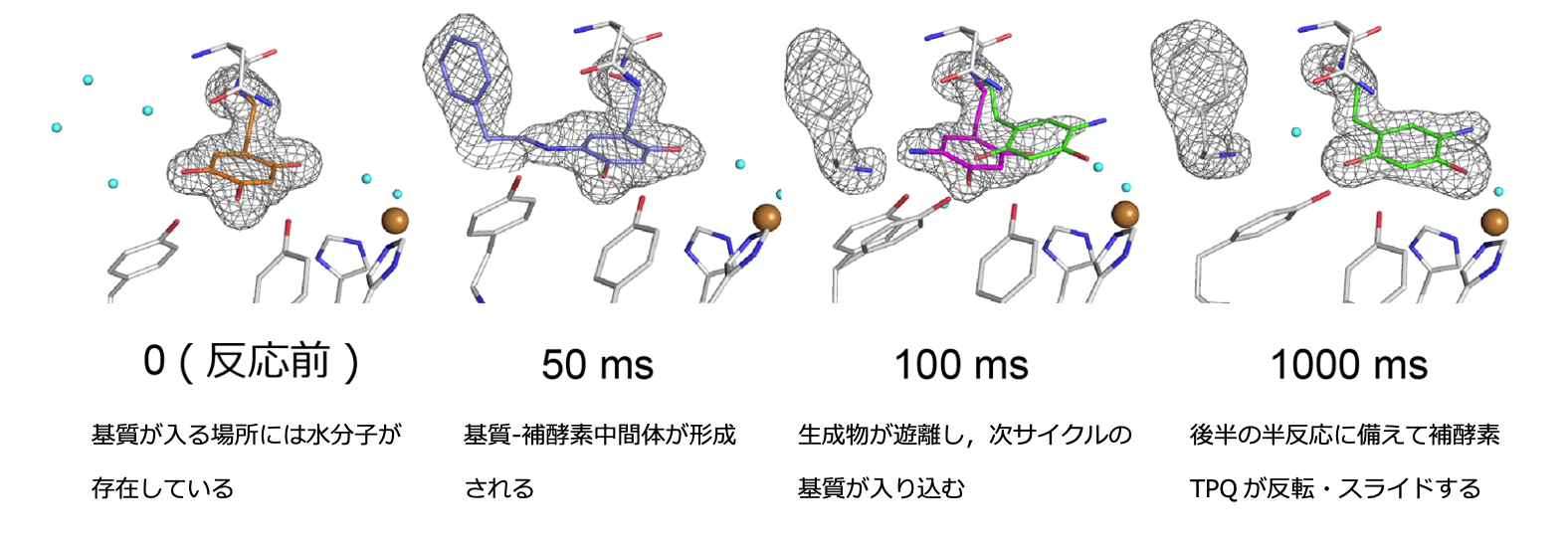
銅含有アミン酸化酵素は様々な生物種に広く存在し、アミン類をアルデヒドとアンモニアに分解する活性を持っています。この酵素の活性中心には、銅イオンと補酵素トパキノン(TPQ)を含んでおり、ヒトの血清中の本酵素は糖尿病の発症にも関与しています。これまで、本酵素は触媒過程で、補酵素TPQが大きく構造変化することが知られていましたが、どのような仕組みで構造変化が起きるのかその詳細な仕組みは不明なままでした。そこで、この疑問を明らかにするため、研究グループは、微生物由来の銅含有アミン酸化酵素を用いて数μmサイズの微結晶を作成し、SACLAにて二液混合法を用いた時分割SFXを実施しました。酵素微結晶懸濁液と基質溶液の混合からXFEL照射までの時間(遅延時間)が異なる複数のデータセット(22 msから100 msまで計9セット)を取得しました。遅延時間の増加に伴い、補酵素TPQとその周辺残基や水分子の電子密度の形状と占有率が変化していることを観測し、反応時間軸に沿った各反応中間体の構造変化を明確にとらえることに成功しました(図1)。
図1 触媒過程での補酵素TPQの構造変化
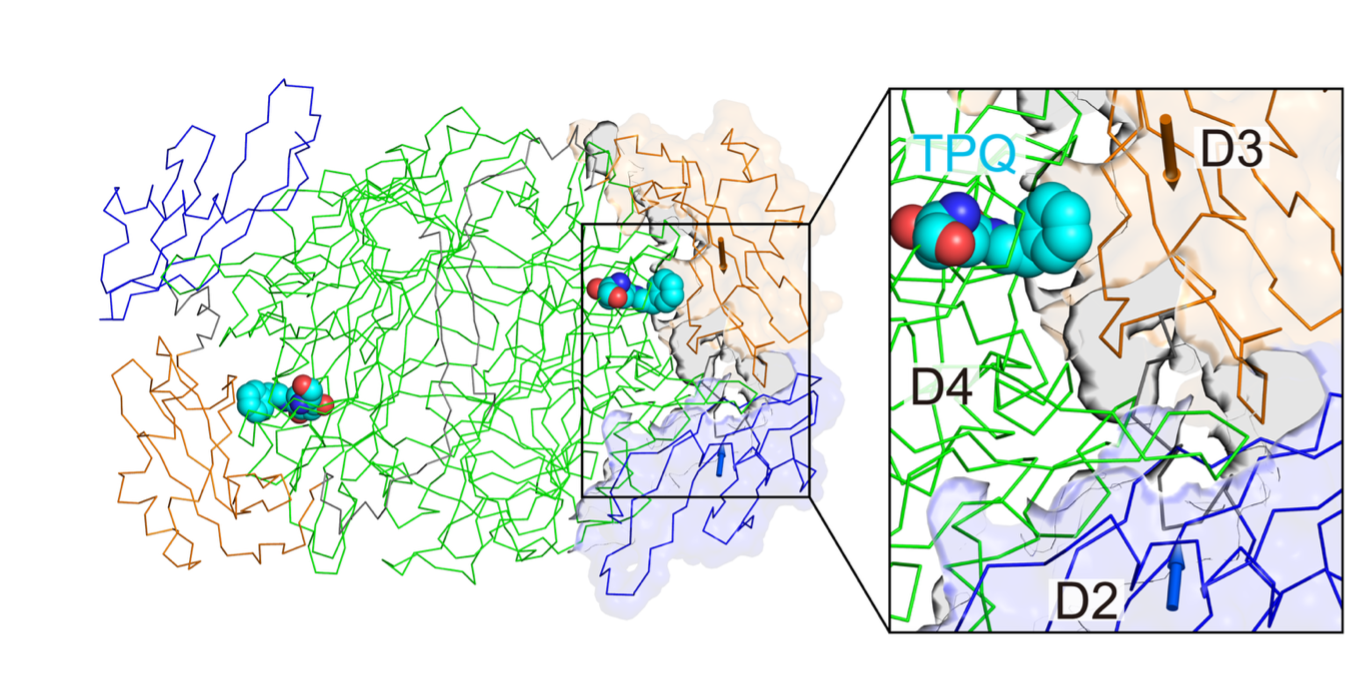
さらに、本酵素の触媒過程での構造変化は活性中心のみで起こると従来は考えられていましたが、基質結合に伴いドメインレベルでの構造変化が起き、これに連動して活性中心での構造変化が進行することが明確になりました(図2)。
図2 触媒過程での銅含有アミン酸化酵素全体の構造変化
基質結合に伴いドメイン2(D2)とドメイン3(D3)が矢印に示す方向に収縮する。本酵素はホモ二量体構造をもちそれぞれのD2、D3で同様の動きがみられる。
このようなタンパク質全体の僅かな動きを検出することは従来の解析法では困難であり,本研究の大きな成果といえます。
【本研究が社会に与える意義(社会的意義)】
今回の研究では、酵素の精緻な動きの一端を原子レベルで明らかにしています。酵素科学における重要な研究テーマの一つに、新しい機能性を持つ酵素の分子設計が挙げられますが、今回の成果は、この分野に大きく寄与する可能性があります。一般的に、酵素は多段階の反応ステップを経由し常温常圧で効率良く働きますが、各ステップにおいて素早く最適な構造をとる必要があります。その動きの原理や基質が化学変化した中間体の構造を理解することは、各種の有用酵素の設計・開発にも大きな進展をもたらすと期待されます。
【研究者のコメント】
高品質の微結晶を大量に得ることは非常に困難でしたが、その苦労のかいあって、想像以上に多くの知見が得られました。二液混合法を用いた時分割SFXは技術的には困難な課題も伴いますが、その原理から多くの酵素反応の適用が可能であり、今回の成果は、多くの酵素科学者にとっての夢である酵素反応のflipbook(パラパラマンガ)作りへの重要な第一歩といえます。
【発表者】
(所属・役職等は全て研究当時のもの)
村川武志:大阪医科薬科大学 医学部 助教
鈴木 守:大阪大学 蛋白質研究所 准教授
福井健二:大阪医科薬科大学 医学部 助教
桝田哲哉:龍谷大学 農学部 教授
溝端栄一:大阪大学 大学院工学研究科 講師
角南智子:量子科学技術研究開発機構 量子生命科学研究所 主幹研究員
登野健介:高輝度光科学研究センター XFEL利用研究推進室 チームリーダー
南後恵理子:東北大学 多元物質科学研究所 教授,理化学研究所 放射光科学研究センター チームリーダー
當舎武彦:兵庫県立大学大学院 理学研究科 教授
矢野貴人:大阪医科薬科大学 医学部 教授
谷澤克行:大阪大学 産業科学研究所 招へい教授
岡島俊英:大阪大学 産業科学研究所 准教授
【用語説明】
※1 X線自由電子レーザー(XFEL,X-ray Free Electron Laser)
X線領域におけるレーザーのことであり、近年の加速器技術の発展によって実現した。大型放射光施設SPring-8(スプリングエイト)などの従来の放射光源と比較して、10億倍もの高輝度のX線がフェムト秒(1,000兆分の1秒)の時間幅を持つパルス光として出射される。この高い輝度を活かし、数マイクロメートル程度の小さな結晶を用いたタンパク質の原子分解能の構造解析に利用されている。また、フェムト秒パルスの特性を活かし、X線照射による試料損傷が顕在化する前の構造を解析することが可能であり、鉄原子を含む酵素など、損傷が顕著な試料の構造解析に利用されている。
※2 SACLA(SPring-8 Angstrom Compact free electron LAser)
理化学研究所と高輝度光科学研究センターが共同で建設した日本ではじめてのXFEL施設。2011年3月に施設が完成しSACLA(サクラ)と命名された。大きさが諸外国の同様の施設と比べて数分の1とコンパクトであるにもかかわらず、0.1 nm以下という世界最短クラスの波長のレーザー生成能力を持つ。高い空間コヒーレンス、短いパルス幅、高いピーク輝度を備えたX線領域のレーザーを発生させる。
※3 連続フェムト秒結晶構造解析(SFX,Serial Femtosecond Crystallography)
多数の微結晶を含む液体などをインジェクター(試料輸送装置)から噴出しながら、X線レーザーを照射し結晶の構造を解析する手法。配向の異なる多数の微結晶からの回折イメージを連続的に収集する。結晶中の分子の微細な動きを高い時間・空間分解能で観察することが可能となる。本研究では、数万枚のイメージデータからタンパク質の立体構造を決定し、反応中間体のスナップショットを構築した。
※4 二液混合装置(二液混合時分割SFX)
酵素微結晶が懸濁した溶液と基質溶液(あるいはリガンド溶液など)をマイクロ流路中で迅速に混合することにより反応を開始し、直径50~100 μm程度のキャピラリー型インジェクターより吐出したストリーム状の混合液に対してXFEL照射を行う手法、またはそのための装置。本手法は、技術的には溶液実験で従来用いられてきたストップトフロー法(正確にはその原型である連続フロー法)を応用したものであり、混合からXFEL照射までの時間(遅延時間)を変えることにより、反応時間軸に沿った様々な中間体結晶の回折測定が可能となる。本手法は原理的には比較的シンプルであり、汎用性も高く各種酵素反応の追跡に応用可能である。今回用いられたキャピラリー型インジェクターの場合は、現時点においては大量の試料を必要とするという難点があり、液滴を用いた手法など他の方法も開発が行われている。
|
お問い合わせ先 |
- 現在の記事
- 働く酵素の姿をミリ秒で捉える ―SACLAが拓く新しい時分割タンパク質構造決定法の可能性―(プレスリリース)
 ompu.ac.jp
ompu.ac.jp