ビタミンB12を用いた光受容タンパク質の活性化メカニズムを解明 ~SACLAが捉えた光化学反応と生命応答の関係~(プレスリリース)
- 公開日
- 2026年02月05日
- SACLA
2026年2月5日
兵庫県立大学
理化学研究所
高輝度光科学研究センター
|
フランスInstitut de Biologie StructuraleのMartin Weik教授及びRonald Rios-Santacruz大学院生(現研究員)、兵庫県立大学大学院理学研究科の當舎武彦教授、理化学研究所放射光科学研究センターの杉本宏専任研究員、公益財団法人高輝度光科学研究センターの大和田成起主幹研究員を含む国際共同研究グループは、ビタミンB12※1を用いて光を感知する光受容タンパク質 CarH の活性化機構の詳細を、X線自由電子レーザー(XFEL)※2施設SACLA※3を活用した時間分解構造解析※4を中心に、種々の計測手法を駆使して解明しました。光受容タンパク質は、視覚、光合成、体内時計など、生命にとって基本的かつ重要な機能に関わっています。細菌のCarH は補因子※5としてビタミンB12を利用する新しいタイプの光受容体ですが、その光応答の分子機構は不明でした。本研究では、光照射によって引き起こされる反応をナノ秒(10億分の1秒)から3秒までの範囲で追跡し、これまでみることができなかった光活性化途中の姿(反応中間体)を捉え、その役割を明らかにしました。本成果は、光によるタンパク質制御の理解を大きく進めるもので、2026年2月4日に英科学誌「Nature」に掲載されました。 【論文情報】 |
【研究の背景】
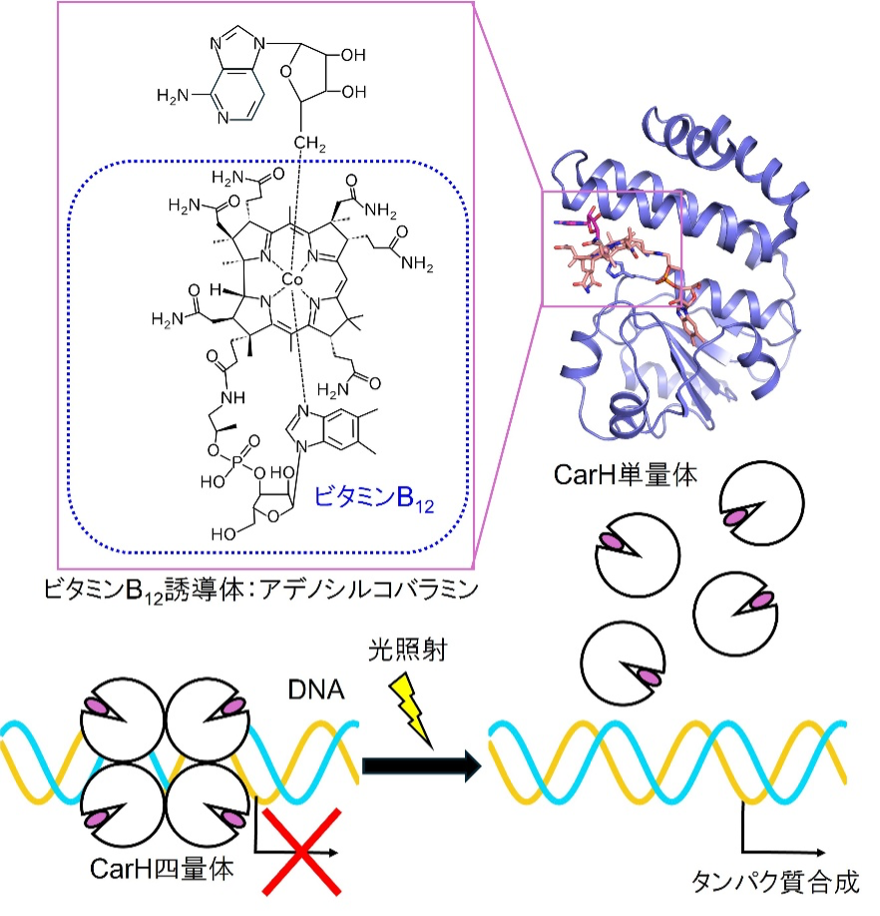
CarHは細菌にみられ、ビタミンB12を用いて光を感知し、カロテノイド※6合成に関わるタンパク質の合成を制御する光応答型転写調節因子※7です。CarHに結合したビタミンB12が光を受容すると、CarHの構造が変化します。その結果、四量体を形成していたCarHが単量体になることで、DNAに結合する能力を失い、タンパク質の合成が制御されます(図1)。ビタミンB12は、酵素の活性部位として機能し、生体内で様々な化学反応を行うことがよく知られています。一方で、CarH のような光受容タンパク質において、ビタミンB12が利用される例はあまり知られていません。CarHがどのようにして「光」による機能制御を可能にしているのか、その要因は明らかになっていませんでした。この疑問に答えるために、CarHが光を受けた直後のナノ秒から、最終的にタンパク質の構造が大きく変化する数秒までの「姿」をみることが重要になります。
図1 CarHの構造と機能。CarHは光を感知するためにビタミンB12を利用している。CarHが光を受けると四量体から単量体へと構造が変化し、DNAに結合できなくなる。
【研究内容と成果】
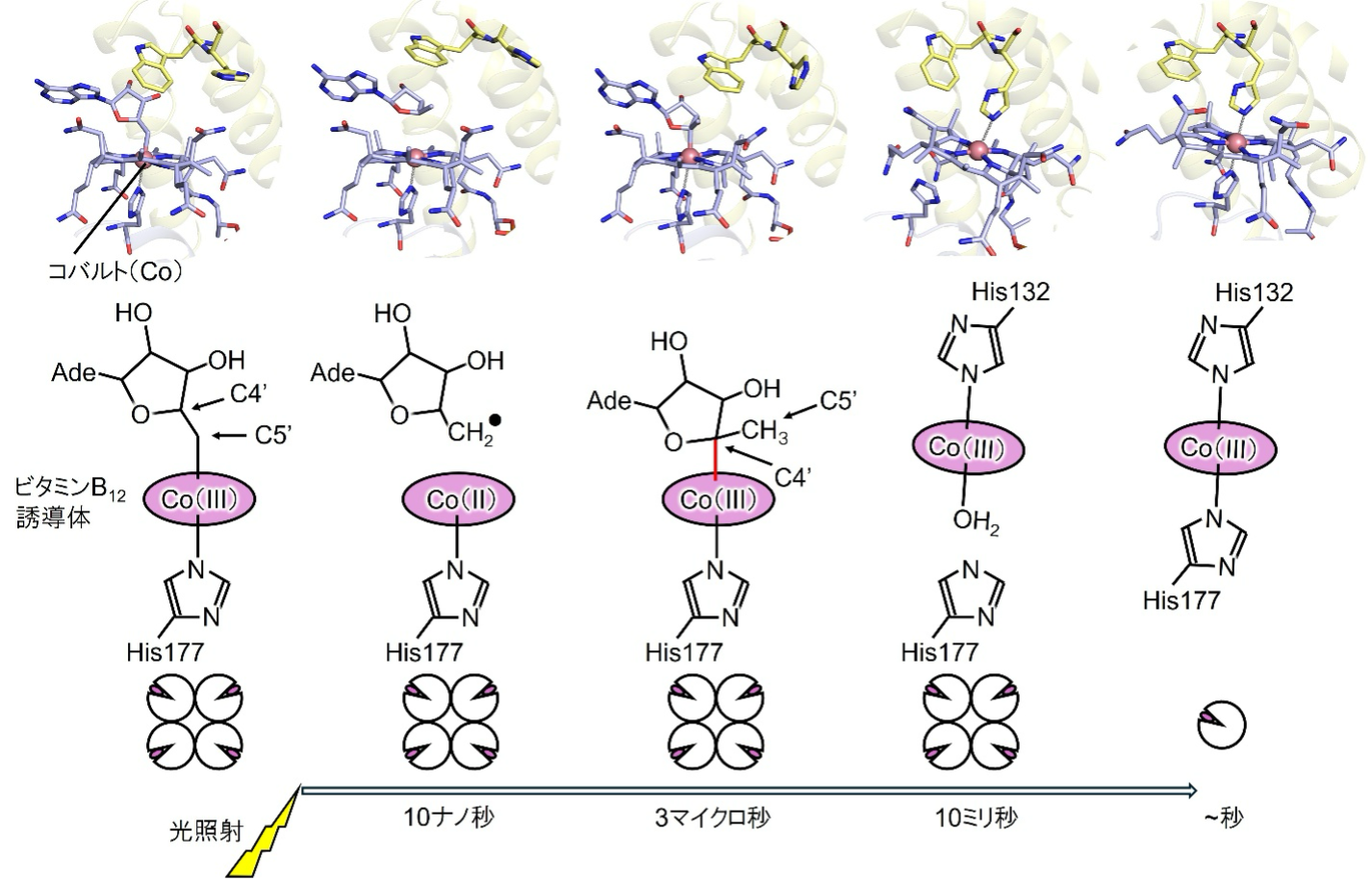
研究グループは、主にXFEL施設SACLAでの時間分解構造解析を利用して、CarH の光活性化過程を詳細に解析しました(図2)。その結果、光照射によってビタミンB12誘導体中のコバルト–炭素結合(Co–C結合)が切断された後、3マイクロ秒(マイクロ秒は百万分の1秒)で、これまで知られていなかった新しい反応中間体が形成されることを発見しました。この中間体では、光を受容する前にみられたビタミンB12誘導体中のCo–C結合(Co–C5’結合)とは異なる新たなCo–C結合(Co–C4’結合)ができており(図2)、その後に起こる大きな構造変化を引き起こす鍵となっていることがわかりました。そして、CarH は四量体から単量体へ変化し、DNA結合能を失うことで転写制御が切り替わります。この仕組みは、ビタミンB12をもつ酵素とは本質的に異なる光受容タンパク質特有のものであることが示されました。
図2 XFEL施設SACLAでの時間分解構造解析で明らかとなったCarHの光活性化の仕組み。本研究では、光照射の3マイクロ秒後にCo-C4’結合をもつ新たな反応中間体を発見した。
【今後の展開】
本研究は、光照射のナノ秒から数秒後のCarHの姿を捉えることで、ビタミンB12を用いた光受容の仕組みを理解した成果です。この知見は、光による遺伝子制御の理解を深めるだけでなく、将来的にはオプトジェネティクス※8への応用や、光をつかってタンパク質の働きを自在に操作する技術への応用が期待されます。
【謝辞】
本研究は、理研が提供するSACLA大学院生研究支援プログラム及び二国間交流事業(フランス(MEAE-MESRI)との共同研究)による支援を受けて実施されました。
【用語解説】
※1. ビタミンB12
コバラミンと呼ばれる化合物の総称で、中心にコバルト原子をもつ大きな環状の有機金属分子である。生体内では、アデノシルコバラミンやメチルコバラミンといった形(ビタミンB12誘導体)で存在し、酵素の活性部位として働く。ヒトや動物にとって必須のビタミンの一種である。
※2. X線自由電子レーザー(XFEL)
近年の加速器技術の発展によって実現したX線領域のパルスレーザー。SPring-8などの従来の放射光源と比較して、10億倍もの高輝度のX線がフェムト秒(1,000兆分の1秒)の時間幅を持つパルス光として出射される。この高い輝度を活かし、数十マイクロメートル以下の小さな結晶を用いたタンパク質の原子分解能の構造解析に利用されている。また、フェムト秒パルスの特性を活かし、X線照射による試料損傷が顕在化する前のありのままの構造の解析や、時間分解測定が可能となる。
※3. SACLA
理化学研究所と高輝度光科学研究センターが共同で建設した日本ではじめてのXFEL施設。2011年3月に施設が完成し、SPring-8 Angstrom Compact free electron LAserの頭文字を取ってSACLAと命名された。大きさが諸外国の同様の施設と比べて数分の1とコンパクトであるにもかかわらず、0.1 nm以下という世界最短波長クラスのレーザーの生成能力をもつ。高い空間コヒーレンス、短いパルス幅、高いピーク輝度を備えたX線領域のレーザーを発生させる。
※4. 時間分解構造解析
タンパク質などの分子の構造が時間とともにどのように変化するかを調べる手法である。光や温度変化などの刺激を与え、その直後からの構造変化を観察することで、反応の途中段階を捉えることができる。これにより、反応がどのようにして進むのか、を構造の変化として理解できる。
※5. 補因子
酵素やタンパク質が働くために必要な、タンパク質以外の成分である。多くの酵素は、補因子が結合してはじめて反応を進めることができる。補因子には、金属イオンやビタミン由来の有機分子などがある。
※6. カロテノイド
黄色や赤色の色素として知られる有機化合物で、植物や藻類、細菌などに広く存在する。光を吸収する性質をもち、光合成の補助や、強い光から細胞を守る働きがある。代表的なものに、ニンジンに含まれるβカロテンがある。
※7. 転写調節因子
DNAに結合して遺伝子の転写を促進したり抑制したりするタンパク質である。細胞が環境の変化に応じるために重要である。
※8. オプトジェネティクス
光に反応するタンパク質を細胞内に導入し、光を当てることで細胞の働きや遺伝子の発現を制御する技術である。光を当てる、場所や時間をコントロールできることが特徴であり、生命現象の理解に役立っている。
|
【問い合わせ先】 |
- 現在の記事
- ビタミンB12を用いた光受容タンパク質の活性化メカニズムを解明 ~SACLAが捉えた光化学反応と生命応答の関係~(プレスリリース)
 ofc.u-hyogo.ac.jp
ofc.u-hyogo.ac.jp