睡眠や生殖器誘導など、多機能なPGDSはしなやかな構造持つ -巾着構造のしなやかな変化が、睡眠誘導物質の合成など多彩な機能を発揮- (プレスリリース)
- 公開日
- 2009年07月10日
- BL45XU(理研 構造生物学I)
2009年7月10日
独立行政法人理化学研究所
財団法人大阪バイオサイエンス研究所
本研究成果のポイント
○PGDSの構造は、内側が空洞の巾着型で、開閉自在のふたも付くことを発見
○しなやかな構造変化が、アルツハイマーの原因物質などと結合し脳保護機能を発揮か?
○PGDSと過食肥満、動脈硬化など実際の病気との関係は今後への課題
|
独立行政法人理化学研究所(野依良治理事長)と財団法人大阪バイオサイエンス研究所(早石修理事長)は、睡眠物質を合成するリポカリン型プロスタグランジンD合成酵素(リポカリン型PGDS)※1の2種類の違う立体構造を解明し、この酵素が、開閉するふた付きの巾着構造を持ち、しなやかに構造を変化させて、睡眠や生殖器誘導など種々の場面で生命活動を支えていることを明らかにしました。これは、理研放射光科学総合研究センター宮野構造生物物理研究室の宮野雅司主任研究員、吾郷日出夫専任研究員、大阪バイオサイエンス研究所の裏出良博部長、有竹浩介研究員らのグループによる共同研究の成果です。 (論文) |
1.背 景
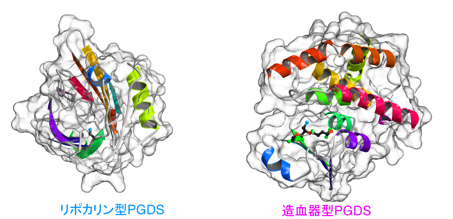
リポカリンファミリー・タンパク質は、巾着構造の中に生理物質を抱え込むタンパク質で、その中でも唯一、酵素活性を持つPGD合成酵素(PGDS)には2種類の構造体が知られています。1つは造血器型PGDSで、1997年の発見とほぼ同時に研究グループがその結晶構造(図1)と反応機構を明らかにしました(Kanaoka Y et al., Cell 90, 1085-1095,1997)。筋壊死にかかわることからデュシェンヌ型筋ジストロフィーの創薬ターゲットとして開発が進んでいます。もう1つは脳型とも呼ばれるリポカリン型PGDSです。頭蓋骨の中で脳を浮かべている脳髄液に多く含まれる糖タンパク質βトレースというタンパク質そのもので、造血器型PGDSと同じ酵素活性を持つことが知られていました。
リポカリン型PGDS は、睡眠誘導する脳内物質PGD2の合成にかかわり、まだよく解明していない現代病の1つである、睡眠障害の機構の一翼を担う代謝酵素として注目され、研究が始まりました。このPGD2は、プロスタグランジンと呼ばれる脂質メディエーター群※7の1つで、発熱・痛み物質として知られているPGE2と対になって働きます。プロスタグランジンは生体内の生理、病態に深くかかわっており、これらの代謝酵素やその特異受容体が多様な疾病に対する創薬ターゲットとなっています。
リポカリン型PGDSは、わずか150個ほどのアミノ酸からなる小さなタンパク質ですが、生命活動のさまざまな場面で多彩な機能を発揮し、私たちの生命を支えています。例えば、水に溶けにくい生体内分子をその内側に取り込んでしまうため、脳が傷ついたときにPGD2を合成して脳を保護する役目を担うと考えられています。さらにオス生殖器の誘導、虚血再還流※8時の心筋保護機能も知られています。しかし、リポカリン型PGDSは構造が柔らかいため、長い間しっかりとした構造解析が進まず、その組み換えタンパク質の生産が困難で、活性型酵素として人工的には大量生産することができませんでした。そのため、長い間構造解析が困難でした。
2.研究手法
研究グループは、大型放射光施設SPring-8の理研構造生物学 I ビームラインBL45XUを利用してX線結晶構造解析を行いました。構造解析には、放射光の波長を変化させるMAD法※9により、散乱したX線の強さと波の位置(位相)を決定して立体構造を決めることができました。SPring-8の強いX線を使ったことが成功の要因で、不安定なリポカリン型PGDSの結晶から、構造解析に必要な精度の良いMADの測定データを得ることができました。しかし、リポカリンファミリー・タンパク質の構造決定の際に誰もが直面してきたように、最終的に信頼のおけるタンパク質構造を決定するためには、非常に多くの構造計算が必要です。そこで、さらに新たな回折データの収集と構造計算に挑みました。具体的にはいろいろな条件で結晶化を試み、リポカリン型PGDS の結晶化には、ビタミンAの誘導体であるレチノイン酸が必須であることが分かりました。そして、さらなる結晶化の試みの過程で、リポカリン型PGDSの中にも違うタイプの構造を持った別の結晶を得ました。さらに次に、活性のある組み換えタンパク質を生産して、リポカリン型PGDSの酵素としての機能を生化学的・純化学的に調べました。
3.研究成果
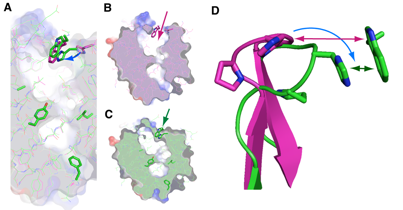
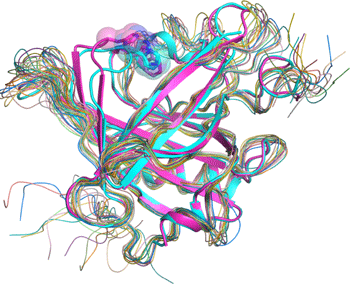
違うタイプの2種類のリポカリン型PGDS結晶を使いX線結晶構造解析を行った結果、その2種類の結晶のリポカリン型PGDSは、巾着構造をしたタンパク質のふたの部分と底の部分が異なった構造を持ち、特にふたに当たる部分が閉じたり開いたりする大きな構造変化を起こしている事が判りました(図2)。この結果は、大阪大学のグループによるNMRを使った解析(Shimamoto S et al., J Biol Chem 282, 31373-31379,2007)、また大阪府立大学と財団法人高輝度光科学研究センターのSAXSを使った解析(Inoue K et al., J Biochem 145, 169-175, 2009)、即ちリポカリン型PGDSの構造がしなやかであると言う点とも良く一致します(図3)。この柔らかくしなやかな構造を持つという特徴により、リポカリン型PGDSはPGD2を合成する酵素タンパク質として働くだけでなく、ビタミンAの誘導体の1つであるレチノイン酸や、チロキサンホルモン類、複合糖質、さらにアルツハイマーの原因物質βアミロイドとまで強く結合する能力を持っていると考えられます。
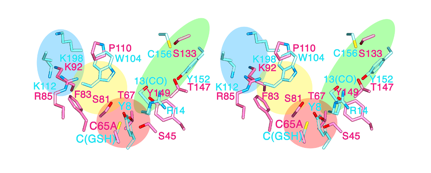
また、活性のあるリポカリン型PGDS酵素で酵素の働きを調べることで、まったく構造の異なるリポカリン型と造血器型PGDSは、PGD2を作る部分の立体的な構造がよく対応していて、酵素としての働き方は同じであることを初めて確かめました(図4)。
4.今後の期待
大阪バイオサイエンス研究所の裏出グループは、今回の成果を創薬につなげるため、さらに発展的な研究を行っています。リポカリン型PGDSが動脈硬化の病態にかかわっているか、そしてその病態改善に既存の特異阻害剤が役立つかということを、マウスモデルなどを使って研究しているところです。もしリポカリン型PGDSがかかわっている病態改善に特異阻害剤が役立てば、より効果的で安全な薬剤開発が可能になります。大阪バイオサイエンス研究所とその共同開発先が、造血器型PGDSが筋壊死の病気であるデュシェンヌ型筋ジストロフィーの薬のターゲット候補になりうることを明らかにしたように、この結果を生かした新たな創薬への展開が期待できます。
<参考資料>
|
|
||||||||||
|
|
||||||||||||
<補足説明>
※1 リポカリン型プロスタグランジンD合成酵素(リポカリン型PGDS)
リポカリン型PGDSは、リポカリンファミリーに属し、その中で唯一、酵素活性を持つタンパク質。
※2 リポカリンファミリー・タンパク質
リポカリンファミリー・タンパク質は、巾着構造の中に脂肪酸やレチノイン酸など油っぽい性質を持った生体物質を抱え込む能力を持っており、これらの物質を運搬すると考えられている。
※3 ノンレム睡眠
睡眠には、レム(REM: Rapid Eye Movement。眼球が激しく動く)という夢を見る睡眠と、ノンレム睡眠という脳が休む睡眠がある。睡眠では、このノンレム睡眠とレム睡眠が交互にあらわれる。脳髄液にたくさんあるリポカリン型PGDSが作るPGD2は自然なノンレム睡眠を引き起こすことが知られている。
※4 デュシェンヌ型筋ジストロフィー
筋ジストロフィー症は遺伝性の進行性筋萎縮症。デュシェンヌ型は筋ジストロフィー症の中で最も頻度が高く、症状も重い疾患。
※5 大型放射光施設SPring-8
兵庫県の播磨科学公園都市にある世界最高の放射光を生み出す理化学研究所の施設。SPring-8の名前はSuper Photon ring-8GeVに由来。放射光とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げた時に発生する、細く強力な電磁波のこと。SPring-8ではこの放射光を用いて、ナノテクノロジー、バイオテクノロジーや産業利用まで幅広い研究が行われている。
※6 NMR
分子や原子を調べる方法の1つである核磁気共鳴(Nuclear Magnetic Resonance)のこと。タンパク質の立体構造の2割程度がこの装置を用いて決定されている。溶液で構造決定できるので動的構造、また比較的弱い分子結合の情報が得られる。
※7 脂質メディエーター群
脂質は油っぽい性質を持った生体物質の一群を指し、数千種類にも及ぶ化合物群となっている。そのうち、発熱・痛み物質として知られているプロスタグランジンE2(PGE2)、睡眠を引き起こすプロスタグランジンD2(PGD2)など明らかな強い生理機能が知られている一群の脂質は、特に生物機能を伝える信号として働いていることから脂質メディエーター群と呼ばれる。最近の研究から単純な脂肪酸も脂質メディエーターとして働いていることが明らかになり、改めて活発な研究対象となっている。
※8 虚血再還流
心臓の冠動脈が詰まったり、脳梗塞後に血液が流れなくなったりする虚血後の治療において、ステントなどの導入などによる梗塞治癒手術をして、虚血患部へ再び血液を流すことを虚血再還流という。心臓の手術などで、手術をするために血流を止め、手術後に血液を再び流すこともいう。そして、しばしばこの虚血再還流時に組織障害が起こることが知られている。
※9 MAD法
MAD(Multiwavelength Anomalous Diffraction;多波長異常分散)法はタンパク質の立体構造を効率的に解析する方法の1つで、光源にX線を使った結晶解析法。X線の波長を変えることができる放射光を用い、波長に依存した原子のX線散乱を解析して結晶構造を知ることができる。得られる信号が微弱なため、従来よりも格段の精度が要求される手法でもある。
|
<報道担当・問い合わせ先> 財団法人大阪バイオサイエンス研究所 (報道担当) 財団法人大阪バイオサイエンス研究所 広報室 報道担当 (SPring-8に関すること) |
- 現在の記事
- 睡眠や生殖器誘導など、多機能なPGDSはしなやかな構造持つ -巾着構造のしなやかな変化が、睡眠誘導物質の合成など多彩な機能を発揮- (プレスリリース)