赤血球の代謝センサー「バンド3」の構造を解明-イオンチャネルと共通するV字型上下逆向き繰り返し構造が存在-(プレスリリース)
- 公開日
- 2010年01月22日
- 電子顕微鏡
2010年1月22日
独立行政法人理化学研究所
長崎国際大学
本研究成果のポイント
○ バンド3を膜の外側に開いた形(外向き)に固定化し、二次元結晶で構造解析
○ バンド3の三次元構造が既知のClC型塩素イオンチャネルと類似構造
○ 赤血球が持つイオン交換輸送機構の構造的な解明に貢献
|
独立行政法人理化学研究所(野依良治理事長)と長崎国際大学(潮谷義子学長)は、酸素の運び屋であるヒトの赤血球※1の細胞膜に多く存在する膜輸送タンパク質※2「バンド3※3」の立体構造解析に成功しました。これは、理研放射光科学総合研究センター(石川哲也センター長)構造生理学研究グループ三次元顕微鏡法研究チームの山口知宏研究員、平井照久チームリーダーらと長崎国際大学薬学部 濱崎直孝教授ら、九州大学大学院医学研究院の康東天教授らの共同研究による成果です。 (論文) |
1.背 景
赤血球の細胞膜(赤血球膜)にはバンド3と呼ぶ膜輸送タンパク質が多く存在し、代謝が活発な組織に適切な量の酸素を供給するための代謝センサーとして、体内で非常に重要な役割を果たしていることが知られています。
バンド3を対象とした生化学的実験は、長年にわたって行われており、そのメカニズムがほぼ明らかになっています。(図1)
具体的には、まず、代謝が活発な細胞が血液中に放出した二酸化炭素を赤血球が取込み、赤血球内で重炭酸イオンに変換します。バンド3は、この重炭酸イオンと血液中の塩素イオンを交換輸送(重炭酸イオンを外に、塩素イオンを中に入換え)します。その結果、赤血球内では炭酸が塩酸に換わって、pH※7が大きく下がり、ヘモグロビンに酸素の放出を促します。こうして、代謝が活発な(二酸化炭素を多く放出している)組織に重点的に酸素を供給することができるため、多くても少なくても害になる酸素を、過不足なく組織に行きわたらせることができます。
一方、バンド3の立体構造の解明については、構造解析に十分な量のバンド3分子を安定に精製することが困難なため、1994年に電子顕微鏡による大まかな構造が報告されて以来(Wang DN et al, EMBO, 1994)、大きな進展がありませんでした。
2.研究手法と成果
研究グループは、バンド3を膜の外側に開いた形(外向き)に安定的に固定することができるH2DIDSという阻害剤を使用しました(図2左)。その結果、バンド3の二次元結晶化を大幅に改善することに成功し、極低温(-269℃)で結晶を観察することができる、大型放射光施設SPring-8の構内に設置されている電子顕微鏡を用いて、ヘリックス※8構造が分かる7.5Å(オングストローム=10-10m)分解能で立体構造を解析することに成功しました(図3)。解析の結果、バンド3の構造は、1分子内で2つのへリックスによるV字型構造が細胞膜に対して上下逆向きに配置しており、それが二量体を形成していることを確認することができました(図3)。注目すべきことに、このV字型の構造は、すでに7本の膜貫通ヘリックスが逆向きに繰り返す構造であることが明らかなClC型塩素イオンチャネルの持つ構造と共通していることが分かりました(図3の赤と黄)。また、これら2つのアミノ酸配列を比較すると、V字に対応する部分では相同性も認められました。ClC型塩素イオンチャネルは、バンド3と同様に塩素イオンを輸送する膜タンパク質で、筋肉などで電位調節などの重要な働きをすることが知られています。
3.今後の期待
バンド3の構造が明らかになったことで、赤血球におけるイオン交換輸送機構の構造的な解明が進むことが期待できます。また、バンド3とClC型塩素イオンチャネルとの類似性を初めて見いだしたことから、イオン輸送体の分類、イオン輸送機構の進化の観点からも重要な知見を得たため、今後の研究の進展に期待できます。
今後は、バンド3の結晶化の条件をより詳細に検討することによって二次元結晶を改良し、原子レベル(3~4Å分解能)での構造解析を行うことを目指します。また、今回はバンド3を外向きに固定する阻害剤を使用しましたが、今後、これを内向きに固定することが知られている阻害剤DEPC※4に類する阻害剤を用いた構造解析も行い(図2右)、バンド3の構造変化を明らかにします。また、ClC型塩素イオンチャネルとの比較から推定できるバンド3の塩素イオン結合部位について、生化学的裏付けを行う予定です。
将来、バンド3の詳細な構造や動作機構の理解が進み、バンド3に関する遺伝病の治療や人工血液の開発などにつながることが期待できます。
《参考資料》
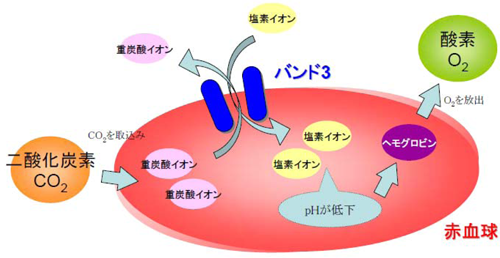
図1 バンド3の働き
赤血球は、代謝が活発な細胞が血液中に放出した二酸化炭素を取込み、赤血球内で重炭酸イオンに変換する。バンド3が、この重炭酸イオンと血液中の塩素イオンを交換輸送することで、赤血球内のpHが大きく下がり、ヘモグロビンに酸素の放出を促す。この機構により、代謝が活発な(二酸化炭素を多く放出している)組織に重点的に酸素を供給する。
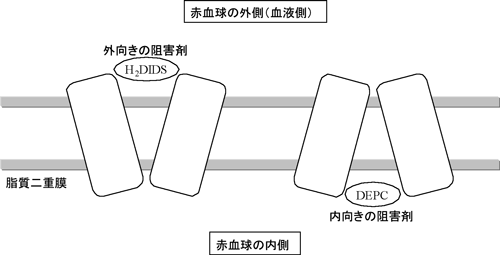
図2 バンド3に対する阻害剤の効果
バンド3は外向きと内向きの構造を交互にとることによりイオンを輸送していると考えられている。阻害剤H2DIDSによりバンド3は外向きに固定される。DEPC阻害剤の場合は、バンド3を内向きに固定すると考えられている。
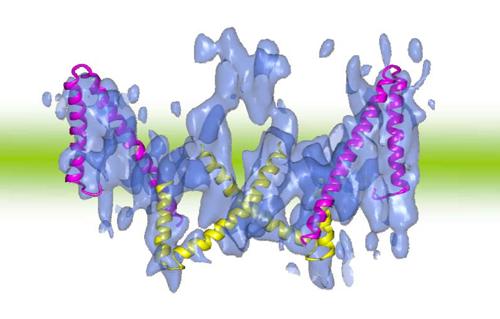
図3 バンド3の三次元構造(外向き)とClC型塩素イオンチャネルのV字型構造
バンド3(青)は、2分子が緊密に結合した2量体を形成している。1分子の中に一組の上下逆向きのV字構造を有する。ClC型塩素イオンチャネルのV字型構造(赤と黄のヘリックスモデル)が良く一致していることが分かる。2つのアミノ酸配列を比較すると、V字に対応する部分で相同性を認めた。
《補足説明》
※1 赤血球
血液は、有形成分の血球と液体成分の血しょうに分類され、血球は赤血球、白血球、血小板の3種類に分類される。赤血球は、内部にヘモグロビンと呼ばれるタンパク質を多く含んでおり、肺から各組織へ酸素を運ぶ重要な細胞である。
※2 膜輸送タンパク質
生体膜に存在するタンパク質(膜タンパク質)の中で、特に輸送機能を持つものを膜輸送タンパク質という。膜輸送タンパク質には単に輸送物質を勾配(膜の内側と外側の濃度などの違い)に沿って通過させるだけのチャネルやATP(アデノシン三リン酸)の加水分解エネルギーや別の輸送物質の勾配を利用して能動的に物質を輸送できるトランスポータがある。チャネルは開閉のために構造変化をすることはあるが輸送中はただの通り穴として働く。トランスポータとして働く場合は、何らかの構造変化を伴って物質を汲み上げる(輸送する)動作を行う。
※3 バンド3
陰イオン交換輸送体1(Anion Exchanger 1:AE1)とも呼ばれる膜輸送タンパク質で、ヒトの赤血球膜や腎集合管に存在する。大きく2つのドメイン、細胞質側に存在する親水性ドメインと、膜貫通ドメイン、で構成される。親水性ドメインはすでにX線構造解析により三次元構造が解明されていた。今回解析した膜貫通ドメインは、陰イオン交換輸送を行うことが知られており、より重要な機能を持つドメイン(残基番号361から911)で、H2DIDSという阻害剤を結合させて外向きに開いた状態で固定したものを結晶化に使用した。バンド3の変異は、東南アジア型楕円赤血球症(SAO)という赤血球の形状に影響を与える遺伝病のほか、遠位尿細管性アシドーシス(dRTA)を発症する原因となる。
※4 H2DIDS、DEPC
いずれもバンド3のイオン輸送を阻害する阻害剤。
H2DIDSは4,4'-diisothiocyanatodihydrostilbene-2,2'-disulfonic acid、DEPCはdiethy pyrocarbonateの略。H2DIDSは細胞膜にあるバンド3の外側から結合する。一方、DEPCは細胞膜の内側から結合する。ただしH2DIDSが結合するとDEPCは結合できず、逆も成り立つ。そのため、それぞれ異なる構造(外向きと内向き)で結合していると考えられている。
※5 二次元結晶
膜タンパク質は脂質二重膜中に存在しているが、二次元結晶は膜タンパク質がこの脂質二重膜中において二次元的に規則的に並んだもの。通常、脂質とタンパク質を別々に可溶化し、それらを混ぜ合わせた後、可溶化剤を透析で抜いて脂質二重膜を再構成させて作製する。この二次元結晶を電子顕微鏡によりさまざまな傾斜角で撮影して三次元データを集め構造解析する。脂質二重膜中で結晶化させているため、三次元結晶よりもより生理的環境に近い状態で観察できる利点がある。
※6 ClC型塩素イオンチャネル
ClC(シーエルシー)型塩素イオンチャネルは筋肉などで重要な働きをするチャネルで、すでにX線でバクテリア由来のホモログの構造が解かれており7本+7本の構造をしていることが分かっている。ClC型塩素イオンチャネルのファミリには、チャネルではなくトランスポータとして働くものもあり輸送機構に関して詳細は不明である。ClC型塩素イオンチャネルの立体構造(X線による構造解析)を発表したロデリック・マキノン博士は、細胞膜チャンネルに関する研究で2003年度のノーベル化学賞を受賞している。
※7 pH
溶液の酸性度を示す一般的な尺度。7が中性で、それより小さいと酸性、大きいとアルカリ性。血液のpHの標準値は7.4であり、正常域は7.36~7.44の範囲。生体内では酸性度とアルカリ性度のバランスが非常に重要で、正常値の範囲から少し外れただけでも多くの器官に著しい影響が出るため、正確に調節されている。
※8 ヘリックス
タンパク質がとる高次構造の1つでタンパク質の構造に共通する特徴的な形である。アミノ酸3.6残基で1回転する右巻きらせん形構造で、1残基あたり1.5Åのピッチを持つ。
タンパク質内のアミノ酸の詳細な形や位置関係が分からない場合でも、へリックスの位置関係を捉えることでタンパク質の特徴、構造変化、近縁関係などを把握、推測することができる。
|
《報道担当・問い合わせ先》 播磨研究推進部 企画課 (報道担当) |
- 現在の記事
- 赤血球の代謝センサー「バンド3」の構造を解明-イオンチャネルと共通するV字型上下逆向き繰り返し構造が存在-(プレスリリース)