がん化学療法の障害となる多剤排出トランスポーターの結晶構造 -体内動態や脳内移行に優れたくすりの開発にも期待-(プレスリリース)
- 公開日
- 2014年03月04日
- BL41XU(構造生物学I)
2014年3月4日
国立大学法人京都大学
本研究成果のポイント
• P糖タンパク質※2(ヒトABC多剤排出トランスポーター)と構造および機能が相同のCmABCB1を温泉に棲む真核生物から世界で初めて発見しました。
• CmABCB1の原子分解能の構造をX線結晶解析で決定しました。
• CmABCB1の動きを止めるユニークな阻害剤を発見し阻害様式を解明しました。
• CmABCB1が多種多様な化合物を排出するメカニズムが原子レベルで解明されました。
|
京都大学(総長:松本 紘)の薬学研究科 加藤博章 教授(理化学研究所客員研究員を兼務)と物質—細胞統合システム拠点iCeMS植田和光 教授、化学研究所 平竹 潤 教授、東京大学理学系研究科 菅 裕明 教授らの研究グループは、がん化学療法の障害となっているABC多剤排出トランスポーターと非常によく似た構造と機能を示す膜タンパク質CmABCB1を温泉に棲む真核生物から発見し、その分子構造と多剤排出メカニズムを解明しました。最初の抗がん剤治療で残った癌細胞が、ABC多剤排出トランスポーターを多数作ることによって多様な抗がん剤に耐性を獲得することは、化学療法の障害となっております。本研究ではX線結晶構造解析の手法を用いて、その分子構造を詳細に解明することにより、多様な化学構造の分子を排出する仕組みを明らかにしました。 |
研究成果の概要
生物はトランスポーターという膜タンパク質を用いて細胞膜の内外の物質輸送を行っています。なかでもATPをその駆動エネルギーとして作用するものがABC(ATP Binding Cassette; ATP結合カセット)トランスポーター※1と呼ばれています。特に有名なのがP糖タンパク質(またはMDR1)ともよばれるABCB1で、多種多様な化学構造の化合物を細胞外へと排出することが知られています。ABCB1は、小腸、血液脳関門、肝臓、腎臓、生殖器に多く存在しており、外界の異物から生体を守る役割を果たしています。一方で、経口投与された薬もABCB1によって体外へと排出されることから、ABCB1との相性が薬の効力と大きく関係しています。
生体防御の要であるABCB1ですが、がんの化学療法を阻害する原因になっています。最初に見つかったがんに対して抗がん剤を投与すると良く効いてがんのほとんどが死滅します。ところが、生き残った癌細胞は、ABCB1を大量に作ります。すると、初回に用いた抗がん剤だけでなく、未使用のいろいろな抗がん剤まで効かない多剤耐性※3を獲得してしまうのです。したがって、ABCB1の分子構造を解明することにより、この多剤排出という不思議な機能を解明することは、基礎科学的に重要なことはもちろん、創薬や医療にとっても重要な意義をもっています。このABCB1遺伝子は、植田和光博士が多剤耐性癌細胞から1986年に世界で初めて単離に成功しました。それ以来、多剤排出というABCB1の不思議なメカニズムを明らかにするために、当研究グループをはじめ世界中の研究者が結晶構造解析を30年近く試みてきました。しかし、ABCB1は細胞から取り出すと安定性が低く、詳細な分子構造の決定はこれまで不可能でした。
そこで、当研究グループは、ヒトのABCB1が不安定で結晶にならないのであれば、高温に棲む生物から性質の良く似た分子を探すことにしました。そして、シゾン(Cyanidioschyzon merolae)という温泉に棲む真核生物に着目しました。そして、ヒトABCB1と遺伝子配列の良く似たCmABCB1(シゾンのABCB1という意味で命名した)を発見しました。そして、当時薬学研究科の大学院生だった崎山慶太が結晶化に成功しました。その後、iCeMSの小段篤史特任助教が数年かけて結晶の分解能を向上させ、薬学研究科の中津 亨准教授といっしょに結晶構造の決定に成功しました。分解能の向上には、化学研究所の渡辺文太助教と大学院生池口圭司の合成した化合物が役立ちました。一方、CmABCB1がヒトABCB1と良く似た化合物排出作用を示すことは、薬学研究科の山口知宏助教を中心に大学院生の藤岡あかね、農学研究科の木村泰久助教の共同研究で明らかになりました。さらに、東京大学理学系研究科のChris Hipolito研究員がCmABCB1の排出扉に外側から閂を掛けるような仕組みの阻害剤aCAPを作り出しました。(aCAPは、さらに結晶の分解能を向上させました。)このaCAPがCmABCB1と結合している姿の構造決定に大きく関わったのは薬学研究科の大学院生廣兼 諒でした。また、不安定な膜タンパク質の結晶であることから、X線結晶構造解析では大型放射光施設SPring-8の利用が必須でした。
CmABCB1の構造と機能
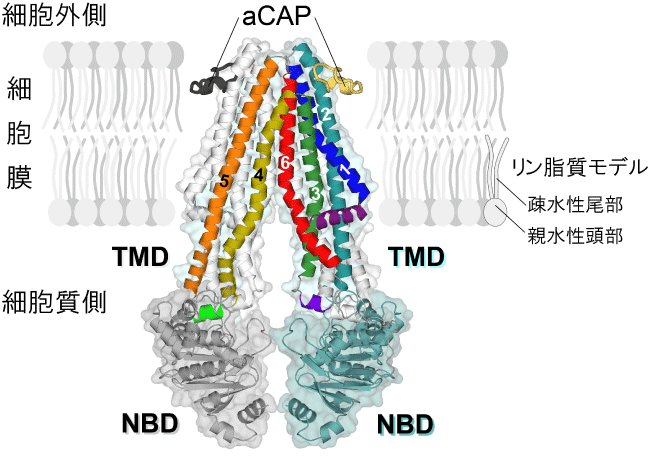
CmABCB1は、細胞膜に埋め込まれた排出ポンプ領域TMD※5と細胞質に浮かぶATP駆動エンジン領域NBD※6からできています(図1)。TMDは、6本の円柱状構造(αヘリックス)の2組、合計12本が巧みに編み込まれることで中央に巨大な空洞を作り、その細胞外側を1番と6番のαヘリックス(TM1とTM6)2組4本で、細胞質側を3番と4番のαヘリックス(TM3とTM4) 2組4本で、それぞれ開口部を作り、それらを結ぶ2番と5番のαヘリックス(TM2とTM5) 2組4本で築かれています。その結果、TMDには、細胞膜と細胞質が接する境界付近に横へ大きく口を開けた化合物取り込み部位ができあがり、そのゲートが化合物の大きさに応じて変化できる柔らかさを持っていることが初めて分りました。そして、その取り込み口の奥、すなわちTMDの中央部に巨大な空洞が作られ、その天井は疎水性※4の化合物が吸着しやすい構造であることが分かりました。さらに、天井の横には天井の中央の開口部(TM1とTM6の2組)を開く引き金となるスイッチがあることも分りました。TMDとNBDは短い連結部位によって結ばれており、ATPの結合、分解、解離の周期で構造変化するNBDエンジンの動作が2番と5番のαヘリックス(TM2とTM5) 2組4本を介してTMDに伝わる仕組みが見えてきました。
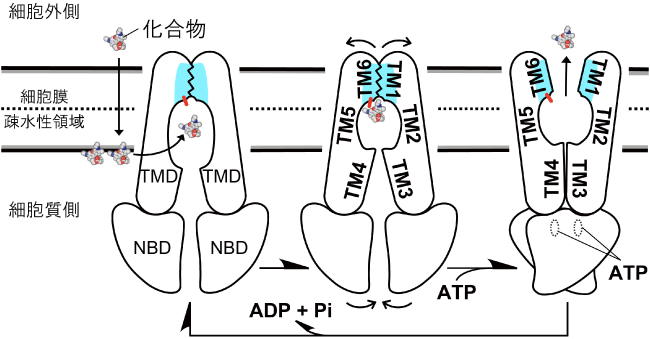
これらの構造と機能解析から導出された多剤排出のメカニズムは、次のようになります(図2)。細胞膜を通過しやすい疎水性の化合物は細胞質には溶け難いため、外界から細胞へと侵入して来ると一時的に細胞膜と細胞質の境界に溜まります。それをCmABCB1は大きさ自在な取り込み口で内部の空洞へと吸い込みます。その空洞の天井は疎水性の化合物を吸着しやすいため、化学構造の違いをあまり問わず、何でも吸い込むことができると考えられます。そして、天井近くの化合物がスイッチに触れることを引き金に天井の扉(TM1とTM6)が開き、化合物は細胞の外へ排出されるというものです。
今回の成果により、多剤排出の基本的な仕組み、また、ABCB1に特異的に結合する阻害剤の新たな設計指針が明らかになりました。これらの情報は,薬の設計合成あるいは薬物治療の改良に役立つものと期待されます。今後、研究チームでは、CmABCB1の作用に伴う動きの全貌を解明し、ABC多剤排出トランスポーターの仕組みと弱点を詳しく解明する予定です。また、CmABCB1で判明したことがヒトABCB1についても当てはまるかどうかを研究する予定です。
《参考図》
CmABCB1は2つのサブユニットが1組で作用する。一方を彩色し、他方は灰色で表した。彩色したサブユニットでは、TMDを構成する6本の円柱状構造(αヘリックスTM1〜TM6)に番号1〜6をつけた。αヘリックスはリボンで表している。TM2(ブルーグリーンと灰色)の細胞外と細胞膜の境界付近には阻害剤aCAP(黄色と黒)が結合している。また、細胞膜との関係がわかるように、膜を構成するリン脂質をモデルで示した。
細胞膜を通過しやすい疎水性の化合物は細胞質には溶け難いため、外界から細胞へと侵入して来ると一時的に細胞膜と細胞質の境界に溜まります。それをCmABCB1は大きさ自在な取り込み口で内部の空洞へと吸い込みます。その空洞の天井は疎水性の化合物を吸着しやすいため、化学構造の違いをあまり問わず、何でも吸い込むことができると考えられます。そして、天井近くの化合物がスイッチに触れることを引き金に天井の扉(TM1とTM6)が開き、化合物は細胞の外へと排出される。天井および細胞質側のそれぞれの扉の開閉の動力は、ATPエンジン(NBD)の動きが供給している。
《用語解説》
※1 ABCトランスポーター
ATP Binding Cassette というATPによって駆動される部位を共通にもっている一群のタンパク質分子。ヒトでは48種類が知られており、そのほとんどが病気と関連している。ABCBファミリーに属するP糖タンパク質は最も有名で、多剤排出トランスポーターとして作用する。この遺伝子を最初に単離したのは、当時米国NIHへ留学していたiCeMSの植田和光教授である。
※2 P糖タンパク質
世界で最初に発見された多剤排出トランスポーターであり、後にABCトランスポーターファミリーに属することが判明した。生体を外界の異物から保護する重要な分子であるが、がん細胞で沢山作られ、がんの多剤耐性の原因として抗がん剤治療の障害ともなっている。
※3 多剤耐性
微生物からがん細胞に至る様々なヒトの外敵が、様々な薬物に対して抵抗性となってしまうこと。不十分に用いられた抗生物質などで生き残った病原菌などが、初回に用いた薬だけでなく、いろいろな薬に対して抵抗性となってしまい、治療を困難にしている。多剤排出トランスポーターの高発現も原因となることが多い。特に、がん細胞では、P糖タンパク質(ABCB1)、MRP1(ABCC1)、BCRP(ABCG2)の3種類のABCトランスポーターが多剤耐性と関わると考えられている。
※4 疎水性と親水性
化合物は、水に溶けやすい「親水性」の物質と油に溶けやすい、すなわち、水には溶け難い「疎水性」の物質がある。また、その両方の性質をもつ「両親媒性」という洗剤のような物質もある。疎水性の化合物は、リン脂質でできている細胞膜になじみやすく細胞膜を透過しやすい。しかし、高塩濃度水溶液である細胞質には溶け難い。
※5 TMD
膜貫通領域(trans-membrane domain)とは、膜内在性のタンパク質の膜中に埋め込まれた領域のこと。ABCトランスポーターの多くは、この領域が化合物輸送のポンプとなっている。
※6 NBD
ヌクレオチド結合領域(nucleotide binding domain)とは、ABCトランスポーターに共通するATPを燃料とするエンジンのこと。ATPは、ヌクレオチドという化合物の1つである。2つの塊でできており、その中央部にATPを結合して分解する装置を持っている。そして、ATPとの結合、ATPをADPとリン酸に分解、生成したADPからの解離、を1サイクルとして2つの塊が結合と解離を繰り返し動力を発生する。これが、TMDに伝わりポンプが駆動される。
|
《問い合わせ先》 京都大学物質—細胞統合システム拠点WPI-iCeMS 京都大学渉外部広報・社会連携推進室 (SPring-8に関すること) |
- 現在の記事
- がん化学療法の障害となる多剤排出トランスポーターの結晶構造 -体内動態や脳内移行に優れたくすりの開発にも期待-(プレスリリース)