SACLAが、放射線損傷のない正確な結晶構造の決定に、タンパク質で初めて成功-世界結晶年2014年、レーザーX線が拓く次の世紀へのマイルストーン-(プレスリリース)
- 公開日
- 2014年05月12日
- SACLA
2014年5月8日
独立行政法人理化学研究所
公立大学法人兵庫県立大学
公益財団法人高輝度光科学研究センター
国立大学法人大阪大学
国立大学法人岡山大学
本研究成果のポイント
• X線放射照射の影響のない、正確なタンパク質の三次元構造を決定
• タンパク質が働く様子の一瞬一瞬の精緻な描画へ着実な第一歩
• 生命科学と物質科学をつなぐ新しい架け橋となる方法の開発
|
理化学研究所(理研、野依良治理事長)、兵庫県立大学(清原正義学長)、高輝度光科学研究センター(土肥義治理事長)、大阪大学(平野俊夫総長)、岡山大学(森田潔学長)は、X線自由電子レーザー(XFEL)施設「SACLA[1]」が発振する“レーザーX線”を用いる「フェムト秒X線レーザー結晶構造解析法」の開発に成功しました。世界で初めてX線による結晶構造解析が成功してから101年目となる世界結晶年(ユネスコ、国際結晶学連合)に達成された、レーザーX線結晶構造解析の世紀の始まりを示すマイルストーンです。これは、理研放射光科学総合研究センター(石川哲也センター長)ビームライン基盤研究部の平田邦生専任技師、吾郷日出夫専任研究員、山本雅貴部長と、兵庫県立大学の新澤(伊藤)恭子准教授、吉川信也特任教授らを中心とした共同研究グループによる成果です。 原論文情報: |
背景
1910年代にドイツのラウエ博士やイギリスのブラッグ親子がX線回折を発見(それぞれ同業績によりノーベル賞受賞)して以来、X線によりさまざまな結晶の原子配列(結晶構造)を明らかにされてきました。生命科学分野では、DNAの2重らせん構造の決定をはじめ、数々のタンパク質の立体的な構造が明らかにされてきました。これらの構造情報は、タンパク質の働く仕組みを知る上で重要な基本情報で、生命機能の解明や創薬の研究に役立っています。特に、放射光[4]という明るいX線光源の登場で急速に研究が進み、すでに構造解析された10万近いタンパク質のおよそ8割が放射光を利用したX線結晶構造解析で決定されています。最近では、大型放射光施設「SPring-8[5]」の明るい放射光を用いて、光合成をつかさどるタンパク質の1つに含まれる触媒の構造が初めて解明されています。
しかし、放射光を光源とするX線結晶構造解析では、「放射線損傷」が、長年の問題でした。多くの水が含まれているタンパク質の結晶では、X線照射後ピコ秒(1ピコ秒は1兆分の1秒)で、水が高い反応性を持つ分子に変化します。この反応性の分子との化学反応で、タンパク質の構造が変わってしまいます。中でもタンパク質の機能を担う「活性部位[6]」は、放射線損傷が起きやすい場所です。そのため、活性部位の正確な三次元原子構造を正確に捉えることが困難になり、タンパク質の働く仕組みを知る上での障害となる場合がありました。このため、放射線損傷の影響を受けることなく、高い精度で立体構造を決定できる新しいX線結晶構造解析の方法が求められてきました。
一方、2011年6月7日に発振に成功した、SACLAのレーザーX線は、SPring-8の10億倍も明るく、放射線損傷が起こるピコ秒の100分の1の10フェムト秒という超極短時間のX線照射で、構造解析に必要なX線回折写真を撮影できます。つまり、放射線損傷がおきるよりも早くデータの測定が可能になります。
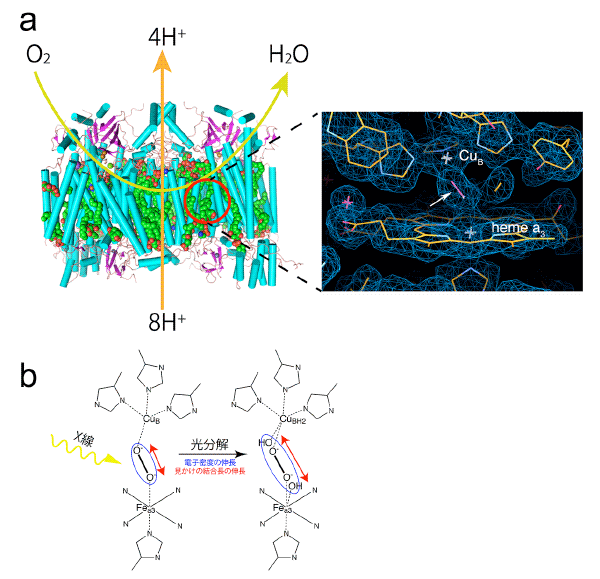
今回、結晶構造解析の対象としたチトクロム酸化酵素の活性部位は、X線に対して感受性が高く、放射線損傷により、わずかですが無視できない構造変化が起きるため、長い間、その働く仕組みを解明することができなかったタンパク質(酵素)の1つでした。チトクロム酸化酵素は生命の根源的な機能を担う膜タンパク質で、酸素呼吸により生体活動のエネルギー物質であるアデノシン三リン酸(ATP)の産生の鍵となります(図1 a)。チトクロム酸化酵素は、空気中の酸素を水に還元して、ATP産生につながるエネルギーを取り出しています。このため、酸素から変化したどのような分子が、どのようにして活性部位に結合しているのかを知ることは、チトクロム酸化酵素の働きを知る上で必要な基本情報です。生化学的及び分光学的実験結果は、過酸化物陰イオンが、酵素反応前のチトクロム酸化酵素の活性部位に結合していると提案しています。しかし、放射光X線結晶構造解析では、過酸化物陰イオンとしては通常あり得ない酸素原子間の距離が解析結果として示され(図1 b)正確な活性部位の様子を知ることはできないままでした。
共同研究グループは、チトクロム酸化酵素を対象とした検証を行い、フェムト秒X線レーザー結晶構造解析が、X線に非常に感受性の高いタンパク質であっても、放射線損傷の影響を受けることなく、かつ高精度で、タンパク質の正確な構造を決められることの証明に取り組みました。
研究手法と成果
フェムト秒X線レーザー結晶構造解析では、SACLAのレーザーX線と大きな結晶の組合せが不可欠です。上述のように、極めて短い時間に大量のX線を結晶に送り込むことができるSACLAのレーザーX線を使うと、放射線損傷の元となる反応性の高い分子が作られるより早く、構造解析で使うデータを集めることができます。これは、放射線損傷のないX線結晶構造解析の必要条件です。これに加え、SACLAのレーザーX線を大きな結晶に照射して、より多くのタンパク質とX線とを相互作用させることで、高い精度で構造を決めるために不可欠な、鮮明なX線回折写真を撮影できます。
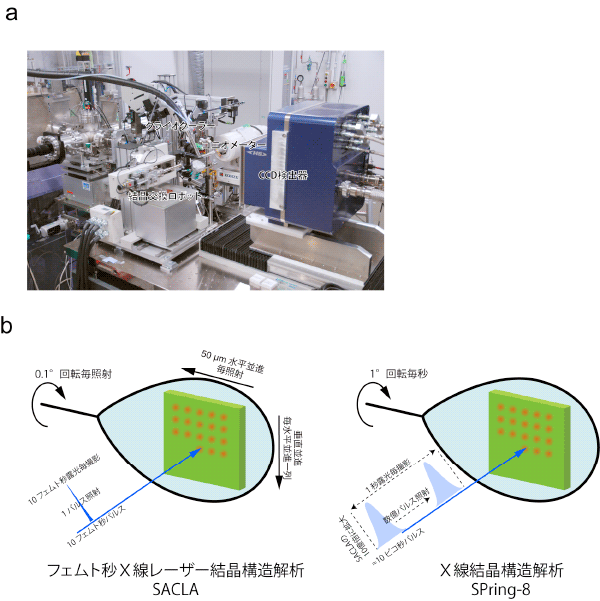
SACLAのレーザーX線を使ったフェムト秒X線レーザー結晶構造解析を実現するため、共同研究グループは、1 µmという細いSACLAのレーザーX線を、結晶上の狙った部位にミクロン精度で照射できる回折実験装置を製作しました(図2 a)。X線結晶構造解析では、さまざまな方向からX線を結晶に当て、1組の三次元的なX線回折写真を撮影する必要があります。しかし、一度X線を受けた部位では、放射線損傷が起きているので、放射線損傷のない構造解析では、結晶の動きを精密に制御し、常に新しい部位にSACLAのレーザーX線を照射してX線回折写真を撮影することが欠かせません(図2 b)。
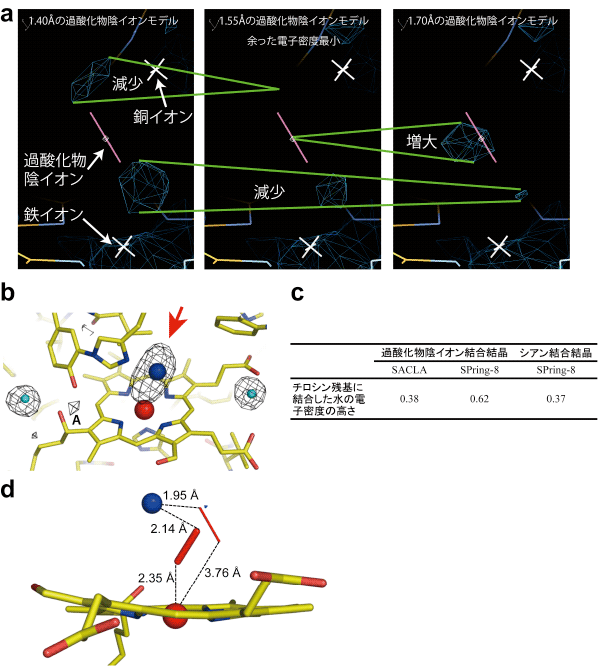
フェムト秒X線レーザー結晶構造解析で集めた放射線損傷のないデータの電子密度は、過酸化物陰イオンが取りうる1.55 Å(オングストローム)の原子間距離を示していました(図3 a)。この結果は、フェムト秒X線レーザー結晶構造解析で放射線損傷のないX線結晶構造解析ができることの証明になります。
次に、過酸化物陰イオン(図3 bの赤矢印)のX線による光分解で生成した水分子が、活性部位のアミノ酸残基チロシン244番に捕獲される現象(図3 bのAの電子密度)に注目しました。活性部位のアミノ酸残基チロシン244番に捕獲された水分子の電子密度の高さは、フェムト秒X線レーザー結晶構造解析では0.38で、この値は、X線によって水分子を生成しないシアン化物イオンを結合したチトクロム酸化酵素の結果と同等でした(図3 c)。この結果は、レーザーX線の10フェムト秒という超短時間の照射の間には、過酸化物陰イオンのX線による光分解が起こらなかったことを示す明確な指標で、フェムト秒X線レーザー結晶構造解析で放射線損傷のないX線結晶構造解析ができることの証明になります。
2通りの観点から、フェムト秒X線レーザー結晶構造解析で放射線損傷のないX線結晶構造解析が可能なことから、チトクロム酸化酵素の活性部位の正確な構造をさらに詳細に調べたところ、存在比率の異なる過酸化物イオンが、2つの金属イオンの双方に結合を持つ構造が明らかになりました(図3 d)。この構造は、これまでに知られている活性部位の磁気的な性質と矛盾がなく、かつ、上述の生化学的分光学的実験結果とも一致します。従って、この構造はX線照射の影響を受けていない正確な活性部位の構造であると結論することができます。
SACLAのX線レーザーの利用で実現した新しい結晶構造解析の方法「フェムト秒X線レーザー結晶構造解析」は、X線に非常に敏感なタンパク質であっても、X線を照射する前の正確な構造を解析できる手段を提供します。高い効率と正確さを持って機能する、優れた分子機械であるタンパク質の精緻な構造を、創薬などの「ものづくり」の設計に取り込む可能性が高まると期待できます。
今後の期待
共同研究グループが開発したフェムト秒X線レーザー結晶構造解析法は、タンパク質の働く様子の一瞬一瞬を精密に描き出す「高精度高速時分割構造解析法」を開発するための基盤となる技術です。タンパク質の働きの高い正確さと高効率性は、タンパク質の正確な「動き」に依存しています。例えば、常温という穏和な環境で化学反応を進める酵素タンパク質の触媒としての働きは、基質が産物へ変換される過程で一瞬だけ現れる遷移状態[7]の構造と相補的な構造に、タンパク質の構造が一瞬変化して強く結合することで実現されています。SACLAの大強度極短パルスX線レーザーが可能にしたフェムト秒の露光時間を活用した高精度高速時分割構造解析法が完成すると、人工触媒デザインの究極のターゲットである「一瞬だけ現れるタンパク質と遷移状態の分子の複合体の構造」だけでなく、タンパク質の働く様子の一瞬一瞬を正確に見ることができるようになります。これによってタンパク質が働く仕組みの全容を初めて知ることができます。これまで手が届かなかったタンパク質の働きの動的な情報を、SACLAを使って引き出すための第一歩が、フェムト秒X線レーザー結晶構造解析の開発であると言えます。
《参考図》
(a)チトクロム酸化酵素は、その活性部位(赤丸)で呼吸で取り込んだ空気中の酸素を水に還元して得られる自由エネルギーで駆動する水素イオン輸送ポンプで、生体膜を挟んだ水素イオン濃度差を作る。この水素イオン濃度差を使って、生体活動のエネルギー物質であるアデノシン三リン酸(ATP)が生合成される。黄緑色の矢印は酸素が活性部位に取り込まれ水に変換される過程を、また橙色は、酸素の水への還元で得たエネルギーを使って、ミトコンドリアの脂質二重膜を挟んだ水素イオンの汲み出しのそれぞれを、模式的に表したものである。右の画像は活性部位の拡大図。本研究でSACLAを使って、観察した放射線損傷の影響のない活性部位の電子密度を表している。白矢印は、酸素が変化した過酸化物陰イオンで、活性部位を作る2つの金属イオン(銅:CuBと鉄:heme a3のFea3)に結合している。
(b)X線結晶構造解析を行うためのX線の照射で、過酸化物イオンが壊れ、過酸化物陰イオンに相当する電子密度(青の楕円で模式的に表す)の長さが伸びるため、これまでのX線結晶構造解析では、X線を当てる前の正確な活性部位の構造を決めることができなかった。
(a)SACLAのレーザーX線を使ってタンパク質結晶から放射線損傷の影響のないX線回折写真を撮影するための回折実験装置。結晶の狙った位置に正確にレーザーX線を照射できる。
(b)フェムト秒X線レーザー結晶構造解析では、10フェムト秒レーザーX線パルスの1パルス照射でX線回折写真を撮影する。それまでの撮影で生じた放射線損傷の影響を避けるため、撮影ごとに結晶を並進して常に新しい場所からX線回折写真を撮影する。また、撮影と撮影の間に結晶を一定角度回転させ、三次元的にX線回折写真を撮影する。これまでのX線結晶構造解析では、数秒の露光時間が必要で、この長時間露光が、タンパク質の放射線損傷が起きる要因である。
線損傷の評価と放射線損傷の影響のないチトクロム酸化酵素の活性部位の構造
(a)(b)の赤矢印で示す電子密度を最もよく表す過酸化物イオンの酸素間原子間距離を調べるために、原子間距離が違う過酸化物イオンを当てはめて構造精密化計算をした。過酸化物陰イオンのモデルの周辺の余った電子密度(紺色の籠モデル、緑の二本線で計算で使った過酸化物陰イオンのモデルの違いによる変化を示す)は、酸素原子間の距離が1.55 Åのとき最小となり、1.55 Åの原子間距離がふさわしいことを示した。
(b)酸素還元部位の放射線損傷のない電子密度図。2つの金属イオン(赤球:鉄イオン、青球:銅イオン)に結合する過酸化物陰イオンの電子密度を赤矢印で示す。この過酸化物の放射線損傷によって生じる水は、近傍のチロシン残基に捕獲される(Aで示す電子密度)。水色球は、水分子を示す。その周辺の電子密度はX線を当てても変化しないので、Aで示す電子密度の正規化に用いた。黄色の線は炭素と炭素の結合を示す。青と黄色、赤と黄色で塗り分けられた線は、それぞれ窒素と炭素、酸素と炭素の結合を示す。
(c)(b)で示す電子密度Aの高さの比較。
(d)放射線損傷の影響のないチトクロム酸化酵素の活性部位の構造。図1bの左の銅イオン(CuB)からヘムa3(Fea3とそれを囲む窒素:N)に相当する部分。
《補足説明》
[1] SACLA
理研と高輝度光科学研究センターが共同で建設した日本のX線自由電子レーザー(XFEL:X-ray Free-Electron Laser)施設。加速器の中で電子の固まりを正確な制御の元で一斉に振動させ、その電子の固まりからレーザーX線を発生させるX線発生装置。2006年度から5年間の計画で建設・整備を進めた国家基幹技術の1つ。2011年3月に完成し、SPring-8 Angstrom Compact free-electron LAser の頭文字を取ってSACLAと命名された。
[2] 放射線損傷
X線の持つエネルギーによって、X線と相互作用した分子が壊れること。X線との直接の相互作用で分子が壊れる場合だけでなく、分子が壊れる過程で生じる電子や、壊れた分子から生成する反応性の高い分子が観察対象の分子と化学反応する場合もある。タンパク質結晶で一般に言われる放射線損傷は、X線と水の相互作用をきっかけに、X線照射後ピコ秒の時間スケールで水から生成する反応性の高い分子がタンパク質と化学反応することで起きる。
[3] 高精度高速時分割構造解析法
タンパク質の働く様子の一瞬を切り取って構造解析するための方法。SACLAのXFELパルスの発光時間は10フェムト秒なので、理論的には10フェムト秒より寿命の長い構造の解析ができる。この解析を実現するためには、結晶内の全てのタンパク質の働きを同期して一斉に起動する技術と組み合わせて実験することが必要となる。
[4] 放射光
放射光は、相対論的な荷電粒子(電子や陽電子)が磁場で曲げられるとき、その進行方向に放射される電磁波。放射光は明るく、指向性が高く、また光の偏光特性を自由に変えられるなどの優れた特徴を持つ。
参考:http://www.spring8.or.jp/ja/about_us/whats_sr/
[5] SPring-8
兵庫県の播磨科学公園都市にある世界最高の放射光を生み出す理化学研究所の施設。SPring-8の名前はSuper Photon ring - 8 GeVに由来する。
参考:http://www.spring8.or.jp/ja/about_us/whats_sp8/
[6] 活性部位
酵素反応が起きるタンパク質上の特定の部位。一般に活性部位には、酵素反応を進めるために、電子分布の偏りを持ったアミノ酸の側鎖や電子が豊富な金属イオンが官能基として存在している。これらの官能基は比較的反応性が高いため、X線照射で水から生じた反応性分子の攻撃を受けやすく、活性部位は放射線損傷の起きやすい部位であるとも言える。
[7] 遷移状態
基質が産物へ構造変化する化学反応の過程にあって、反応中の分子が特別に高いエネルギー状態にある状態を指す。基質が遷移状態になるには、大きなエネルギーが必要なため、基質を産物に変換するには、触媒を使って、基質が遷移状態に至るエネルギーを下げることが必要。
|
《問い合わせ先》 放射光科学研究推進室 (報道担当) (SPring-8に関すること) |
- 現在の記事
- SACLAが、放射線損傷のない正確な結晶構造の決定に、タンパク質で初めて成功-世界結晶年2014年、レーザーX線が拓く次の世紀へのマイルストーン-(プレスリリース)