Topic 27 重金属高蓄積植物のメカニズムの研究
重金属汚染土壌を浄化する植物の秘密を探る
ある種の植物は、生長の過程で環境から重金属を取り込み、体内に高濃度に蓄積する。生育土壌の300倍の濃度の重金属を濃集する例も報告されている。この蓄積作用を活用して重金属で汚染された土壌を浄化するファイトレメディエーション(植物を用いる環境修復)が近年注目を集めている。この特殊な現象を実用的な環境浄化技術とするためには、植物の体内での重金属のふるまいを知る必要がある。そのためには重金属元素の細胞レベルでの分布や化学形態の解明を行わねばならないが、SPring-8の高エネルギーX線マイクロビームがこれを可能にした。その世界初の研究成果を紹介しよう。
生きたままの植物の含有元素を測定
重金属元素を取り込んだ植物を刈り取ることで、土壌から有害な重金属元素を除去するのがファイトレメディエーションだ。従来の重金属汚染土壌の浄化法と比較すると省エネルギーかつ安価で、環境にもやさしい。ヒ素、鉛、カドミウム、クロム、放射性元素などで汚染された土壌は世界各地で問題となっており、ファイトレメディエーションの潜在的な需要は大きい。
ただし重金属の超蓄積性を示す植物は、全植物のごく一部にすぎない。例えば、2001年にイノモトソウ科のモエジマシダにヒ素の超集積性が認められたが、これは、陸上植物としては、初めて報告されたヒ素超集積性植物であった。その後、日本でもアブラナ科のハクサンハタザオに亜鉛やカドミウムの超集積性が見出された。重金属高集積植物のファイトレメディエーションへの応用はまだ端緒についたばかりである。
さまざまな重金属高集積性植物を見つけ出し、これらを土壌浄化に活用するには、重金属をどこにどのように蓄積するのか、なぜ一般の植物よりも高濃度に蓄積できるのかなど多くの疑問を解決する必要がある。
2003年4月、この疑問への答えを、X線による画像化の手法で得る研究を開始したのが、中井泉教授、保倉明子助教(現・東京電機大学准教授)ら東京理科大学理学部の研究グループだった。数多くの植物の重金属高集積能を調べていた同グループは、日本でモエジマシダによる土壌浄化の事業化をスタートしていた建設会社株式会社フジタの北島信行博士との出会いからモエジマシダにターゲットを絞った。ヒ素高集積性の解明を目指したが、1 μm(マイクロメートル=10-6 m)の分解能での解析が必要だった。「細胞レベルの元素分析と化学形態分析ができるのは、X線マイクロビームと蛍光X線を組み合わせたSPring-8の分光分析ビームラインBL37XUしかありませんでした」と中井教授は語る。
葉に至るまでのヒ素の変遷を解明
X線を試料に照射すると試料構成元素の内殻の電子が励起・放出され、生じた空孔に外側の電子が移る(遷移)と、この2つの電子のエネルギー準位の差に応じた蛍光X線が発生する。この蛍光X線のエネルギーは元素に固有であるため、得られたスペクトル(波長ごとの強度の分布)から構成元素を知ることができ、蛍光X線強度から、元素濃度を求めることができる。この分析法を蛍光X線分析(XRF)という。ただし放射光を使わないXRFでは、X線の平行性が悪いので10 μmの空間分解能の分析が限界で、植物組織内の複雑な元素の足どりを細胞レベルでつかむのは難しい。そこで放射光の高い輝度と平行性をいかしてX線をマイクロビーム化し、含有元素の二次元分布を測定するのが放射光マイクロビーム蛍光X線分析(SR-μ-XRF)である。
SR-μ-XRF は生きたままの植物や生鮮組織の測定が可能だが、植物の組織・細胞レベルで元素分布を明らかにするためには、測定中に乾燥などによる組織の収縮・変形や含有元素の移動・流出のない試料調製を行うための工夫が必要である。中井教授たちは植物学の専門家の協力を得て、植物の栽培と試料作成のノウハウを蓄積していった。例えば、細胞レベルの構造を保持するには、試料を急速凍結し、細胞内での氷晶生成を抑えることで、細胞レベルでの試料形状を保つという手法をとる。この凍結法を用いることで、生きた状態に近い試料のXRFイメージングを可能にし、元素分布と植物組織構造の解剖学的な位置関係の測定が期待できるようになった。
また試料の厚みもきわめて重要である。150 μm程度の切片では植物細胞が数個重なってしまい、1つの細胞の分布を知ることができない。研究グループは、手法を工夫し、厚さ10〜20 μmの凍結切片の作成に成功した。
こうした入念な準備の末、SPring-8での計測が開始された(図1)。モエジマシダは、株式会社フジタの北島氏と理化学研究所の阿部知子博士の協力のもとに栽培を行い、最適な生育条件の試料を分析に供給できた。モエジマシダをヒ素水溶液に移し、一定時間経過した後、葉から凍結切片を作成する。そしてこの試料に約2 μm角のマイクロビームを使い、3 μm間隔で0.3秒ごとの走査を行う。すると時間とともにヒ素の分布が広がる様子が可視化された(図2)。
なんとヒ素は投与から30分後には「ヒ素収納庫」の役割を担う葉の周縁部に到達していた。驚くべき迅速さである。この部位でヒ素は通導組織にまず集積し、側糸と偽包膜に優先的に分配されることもわかった。

生きた状態に近いモエジマシダの凍結切片の分析もBL37XUで可能になった。
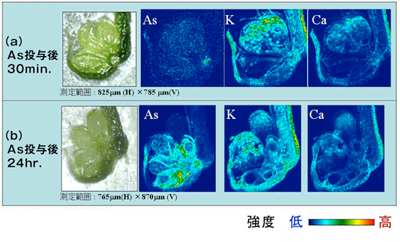
(a)ヒ素投与後30分の各元素の分布。30分でモエジマの羽片の胞子嚢の基部までヒ素は到達する。
(b)ヒ素投与後24時間の各元素の分布。ヒ素は胞子嚢の基部に濃集するが、胞子の中に入ることは抑制されている様子が観察される。
米に含まれるカドミウムも高感度に分析
研究グループは、カドミウムを蓄積するハクサンハタザオ、ヘビノネゴザなどさまざまな植物も研究している。ヒ素などと比べ原子番号の大きいカドミウムの内殻の電子を励起するには、SPring-8の高エネルギー放射光が不可欠である。JASRIの寺田靖子主幹研究員のグループは、BL37XUにおいて、1 μmの高エネルギーX線ビームによるSR-XRF分析を世界で初めて実現し、カドミウムの細胞レベルの分析ができる世界唯一の実験ステーションとなっている。
ハクサンハタザオの葉について、カドミウムや共存する元素の分布も調べると、カドミウムは、亜鉛やマンガンとともにトライコームに蓄積されていた。トライコームとは葉の表面に点在する毛状突起組織で、直径20 μm 程度の微細な細胞からなる。X線マイクロビームで分析したところ、その節においてカドミウムが濃集していることが明らかになった。さらにX線吸収スペクトルによりトライコーム細胞内に蓄積されたカドミウムの化学形態を調べたところ、酸素あるいは窒素と結合していることがわかった。
一方、研究グループは、イネに含まれるカドミウムの二次元分析も試みた。玄米のカドミウム含有量は法規制対象だが、植物中の微量カドミウムの分析はきわめて手間のかかる難しい分析とされる。しかし高エネルギーSR-XRFをおこなうことで玄米内のカドミウムの分布を容易に調べることができる。その結果、カドミウムを1 ppm添加して栽培したイネの玄米において、カドミウムは可食部の白米(胚乳)に一様に分布していて、精米しても取り除けないことが明らかになったのである(図3)。
こうして同グループは、植物中のヒ素やカドミウムの蓄積部位と化学形態を世界で初めて細胞レベルで解明した。中井教授は「高エネルギーSR-XRFは植物中の重金属元素の分析に大変威力を発揮します。放射光によって今後も重金属超蓄積植物の仕組みを明らかにしていきます」と意欲を語る。
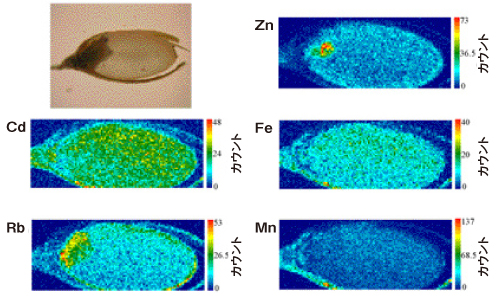
必須元素の亜鉛は胚に濃集しているが、カドミウムは白米として食べている胚乳に均一に分布していることがわかった。