Topic 2 高分子複合体の結晶構造解析
タンパク分子にひそむ究極のスイッチ機構を解明する
サルモネラ菌、大腸菌などの細菌は、数本のべん毛という器官をプロペラのように回転させ移動している。根元に毎秒200〜400回という高速回転をするモーターと軸受け、回転シャフトなどをもち、べん毛繊維をプロペラのように回転させ、1秒間に体長の20倍もの距離を移動する。人間のサイズに換算すると、時速100 km以上のスピードである。まさにパワフルにして精巧なナノマシンなのだ。そして細菌の敏捷な方向転換を可能にしているのが、べん毛を構成するタンパク質分子内のスイッチ機構だ。SPring-8において、ナノテクノロジーのヒントがつまった究極の省エネルギー機関であるべん毛のスイッチ機構が世界で初めて解明された。
原子レベルのタンパク質構造解析
べん毛繊維は直径20 nm(ナノメートル=10-9 m)、長さ十数μmで、素繊維と呼ばれる11本の細長い繊維が円筒状の束になってできている(図1、図3)。この素繊維を構成するのがフラジェリンという分子量約5万のタンパク質分子である。フラジェリン分子がすべて同じ大きさと形であれば、べん毛繊維は直線状の繊維にしかならず、べん毛モーターがいくら高速回転しても推進力は発生しないが、細菌はきわめて敏捷に方向転換を行い、自在な動きを見せる。これは、周期長が5.19 nmと5.27 nmとわずかに異なる素繊維がべん毛繊維を形成する11本のうちに混在することによって、べん毛が緩やかにねじれて左巻きらせん構造を形成しているからである。
細胞膜内で高速回転するべん毛モーターが急反転すると、べん毛繊維にねじれが加わり、何本かの素繊維構造が切り替わって、らせんが左巻きから右巻きに変換する。まっすぐ泳ぐとき束になっていたべん毛は、これによってほぐれ、推進力のアンバランスが生じることで運動方向を変えているのだ。わずか0.08 nmというフラジェリン分子の周期差が敏捷な方向転換を可能にしているわけだ。
べん毛は、ナノマシン開発をめざす世界中の科学者が競って研究しており、べん毛繊維については、2次構造の分布や配列様式などは明らかになっていたが、素繊維の高精度スイッチ機構の実態は不明だった。これを解明するには、原子レベルでの詳細な構造決定が必要だったが、その解析には誰も成功していなかった。
1996年8月、この未踏の領域に足を踏み入れたのが、松下電器産業先端技術研究所の難波啓一リサーチディレクター(現・大阪大学教授)がリーダーを務める科学技術振興事業団・創造科学技術推進事業(ERATO)難波プロトニックナノマシンプロジェクトの研究チームだった。「私たちは、フラジェリン分子の立体構造解明をめざしましたが、フラジェリン分子の結晶試料の大きさはせいぜい数μmで、一般のX線装置でデータ収集できるようなしろものではありませんでした」と難波教授は当時を振り返る。
そこで研究チームは世界一の解析能力を誇るSPring-8の高輝度X線に期待を寄せた。
ただしここにも難関があった。フラジェリン分子の立体構造解明には、分子が整然と並んだ結晶試料が必要だが、フラジェリン分子は重合して長い繊維状になりやすく、結晶化が困難だった。そこで、サルモネラ菌のべん毛のフラジェリン分子から繊維形成と構造安定化に重要な領域を切り取り、繊維構造形成能力を失った分子量約4万のフラグメント(F41と略記)を調製した。そして、これを用いて良質な結晶試料の作成を成功させたのである。
1998年2月、研究チームはこの試料をSPring-8に持ち込み、理研構造生物学IビームラインBL45XUにおいて多波長異常分散法(MAD法)による解析を開始した。MAD法とは、タンパク質の結晶試料にX線を照射したとき、特定の原子によって散乱されるX線の強度が、照射X線の波長に応じて異なるという現象を利用し、結晶構造を解析する方法である。「試料は厚さ数ミクロンの薄い板状だったため、データ収集は困難を極めましたが、結晶を凍結させる際に平板を保つよう工夫を重ね、0.2 nmの分解能でフラジェリン分子の構造を決定することができました」と難波教授。
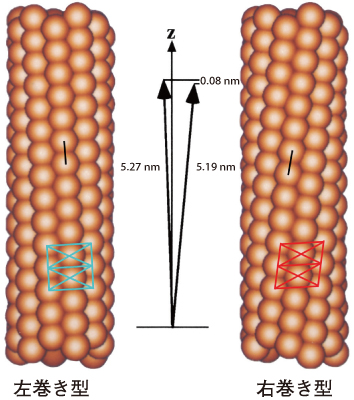
粒子状に示しているのがフラジェリン分子。素繊維の周期長は約5.2 nmだが、右巻きらせんと左巻きらせんでは周期長が0.08 nm異なるために、曲がってねじれたらせん型プロペラを形成できる。
コンピュータ・シミュレーションでスイッチ作用を再現
F41は3 つの領域D1、D2、D3からなり、D1領域は3本の長いαヘリックスと1本のβヘアピンで構成されていた。αヘリックスとはポリペプチド(タンパク質の基本構造)が右巻きらせんに折り畳まれた構造で、βヘアピンはポリペプチドがヘアピンのように鋭く折れ曲がった構造である。D2領域とD3領域のほとんどはβシートやβヘアピンでできていた。そして驚いたことに、モノマーを結晶化したため結晶構造中に見えるとはまったく期待していなかったべん毛素繊維の構造が、その向きを互い違いにしてシートをつくり、それが積み重なって結晶になっていたのである。
研究グループは、解析データをもとにして素繊維のスイッチ機構をさらに詳細に調べるため、フラジェリン分子のふるまいに関するコンピュータ・シミュレーションを行った。まずフラジェリン分子3個からなるモデル素繊維をコンピュータの中につくり、最上部の分子を固定し、最下部の分子を0.01 nmずつ引き下げ、中央の分子に加わる張力による構造変化を観察した。当初、フラジェリン分子は徐々に伸びるだけだったが、ある程度引き下げた段階で、フラジェリン分子どうしが接触する部分にあるβヘアピンが、わずかに、しかし急激に構造変化した(図2)。「これは周期長を0.08 nm切り替えるスイッチが、このヘアピン付近の構造に存在することを示していたのです」と難波教授。SPring-8で解析されたフラジェリン分子の構造データが可能にした「0.08 nm のトリック」解明の瞬間だった。難波教授たちの研究グループは、フラジェリン分子というタンパク質の中に潜んでいる精巧な力学的スイッチを発見したのである。
「フラジェリン分子が特別なタンパク質であるということではありません。私たちの発見によって、立体構造をもつ無数のタンパク質が実現している精巧な動作機構の一例が実証されたのです」と難波教授は語る。
ナノテクノロジーの研究者たちはタンパク質の構造や機能の究明を続けている。それは、タンパク質がナノマシンとして機能し、ナノマシンの設計原理を秘めているからである。タンパク質のふるまいを原子スケールで探求していくことで、人工ナノマシンの手本となる驚くべき仕組みをタンパク質は私たちに教えてくれるということだ。
そのためには、ナノマシンとして機能するタンパク質の立体構造を解明し、柔軟かつ高精度なタンパク質ナノマシンの設計原理を知る必要がある。その原動力が、ナノスケールの世界に切り込むSPring-8の解析技術なのである。
タンパク分子に潜む超高精度スイッチ機構を解明したERATO難波プロトニックナノマシンプロジェクトの成果は、2001年3月発行の英科学誌『Nature』に掲載され、回転するべん毛繊維の立体構造図が同誌の表紙を飾った。
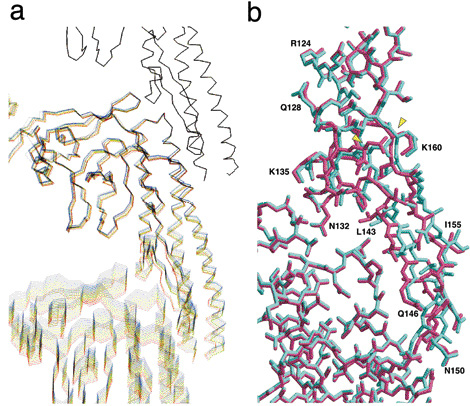
a図は、フラジェリン3分子からなる素繊維モデルによる、素繊維周期長の高精度スイッチを実現するフラジェリン構造変化のコンピュータ・シミュレーションの様子を示す。3分子の一番上を固定したまま一番下の分子を0.01 nmずつ下へずらして素繊維を引き延ばし、真ん中の分子に機械的なストレスを与えてその反応を見た。シミュレーション全体から0.05 nmごとの12ステップを青から赤へ虹色にして重ね書きしてある。表示したステップ9(引き延ばし距離0.45 nm)までは分子全体が徐々に引き延ばされるのみであるが、ステップ9からステップ10(引き延ばし距離0.5 nm)の間でβヘアピン周辺に明確な構造変化が見える。
b図は、a図のシミュレーションで構造変化が観察されたβヘアピン周辺構造を拡大し、スイッチ前後で2つ重ね合わせて示したもの。スイッチ前がシアン、スイッチ後が濃いピンク。上のフラジェリン分子のβヘアピン(中程右側から右下に伸びる構造で、N132からL143、Q146、N150、I155を経由してK160まで)のみが急激な構造変化を見せ、ここにスイッチ作用があることを示している。構造変化は、二つの構造が大きくずれていることからわかる。
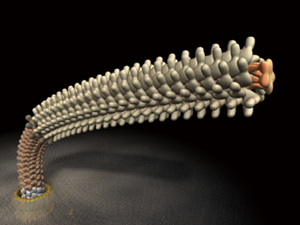
べん毛は、約30種類のタンパク質分子がそれぞれ数個から数万個自己集合して、リング状やらせん状の構造体を形成する。順序よく構築が進むその自己構築機構もナノマシン実現の貴重な手がかりとなる。
- 目次に戻る
- 次のページ
Topic 3 X線小角散乱法による時計タンパク質の実時間解析 - 前のページ
Topic 1 膜タンパク質の構造解析