Topic 1 膜タンパク質の構造解析
生体膜におけるタンパク質のふるまいを探る
生命の基本単位である細胞は、リン脂質の二重膜である細胞膜で包まれている。さらに核、ミトコンドリアなど細胞内小器官もリン脂質膜で囲まれている。これらの膜には、タンパク質の3分の1を占めるさまざまな「膜タンパク」があり、多様な機能を発揮する。例えば、神経が興奮するとナトリウムを細胞内へ、カリウムを細胞外へ流入出させるのも膜タンパク質だ。細胞膜に埋まったこの扱いのやっかいな膜タンパクの構造と機能の謎解きは困難を極め、生物学の中心的なターゲットのひとつとなっている。SPring-8では、膜タンパクの構造の可視化が次々と実現し、医学や薬学の進歩を牽引している。
ロドプシンの構造の可視化に成功
網膜の視覚センサー分子、ロドプシンは視覚というもっとも情報の多い信号を受ける。このロドプシンは「Gタンパク質共役受容体(GPCR)」の一種でもある。GPCRは超高感度センサー膜タンパクとして幅広く活躍しており、視覚・嗅覚信号や免疫信号などのわずかな信号にきわめて敏感に反応し、多くの機能を連鎖的に作動させるスイッチの役割を担う。
理化学研究所(理研)播磨研究所の宮野雅司主任研究員とワシントン大学のパルチェフスキー教授の研究グループはウシ・ロドプシンの構造解析を続けてきた。「GPCRの8割はロドプシンタイプですが、ロドプシンは結晶化が困難な上、結晶の再現性が悪く、構造解析が進んでいませんでした」と宮野主任研究員は語る。
ロドプシンの結晶化は案の定困難を極めたが、ワシントン大学の岡田哲二研究員(現・学習院大学教授)は理研と名古屋大学の研究室における5年以上の地道な努力の結果その結晶化に成功した。この結晶が2000年初春にSPring-8に持ち込まれた。理研の山本雅貴研究員(現・基盤研究部長)を含む研究グループは、多波長異常分散(MAD)法に最適化した理研構造生物学IビームラインBL45XUで数十の結晶でX線回折実験を試みた。MAD法は原子の散乱を波長ごとにとらえる解析法で、水銀で標識したタンパクを用いれば、ただ1つの結晶からでも構造の解析ができる。
研究グループはデータの解析を進めると、ロドプシンおよびそれに結合したビタミンA誘導体レチナールの構造決定に成功した(図1)。ウシ・ロドプシンは7本のαヘリックスをもつ。αヘリックスとは、アミノ酸がらせん状に結合したタンパク質の基本構造である。αヘリックスは細胞膜の内外を貫通する形で存在し、最後の1つは短く90度に曲がっていた。さらに視覚に疾患をもたらす突然変異の多くはαヘリックス間を安定化させる水素結合部分のアミノ酸変異であることも判明した。
この研究成果は2000年8月に米科学誌『Science』に発表され、同誌の査読者からは「この分野における15年間の研究でもっとも重要な論文」との評価を受けた。現在開発されている医薬品のなんと半分はGPCRを標的としており、代表的なGPCRであるロドプシンの構造に関する一連の発見は医薬品開発の基盤となる知見とされ、論文の引用件数は世界でもトップレベルの2700件に達している。
宮野主任研究員と岡田教授は、この業績により2010年度文部科学大臣表彰(研究部門)を受賞した。
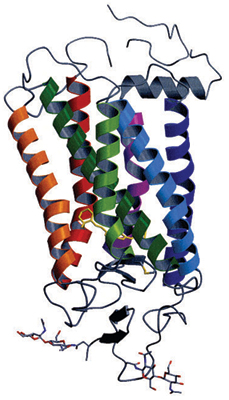
7つのαヘリックスが細胞膜の内外を貫く構造や90度に曲がった短いαヘリックスの存在などが確認された。黄色の分子がレチナールである。
カルシウムポンプの構造を解明する
筋肉には筋小胞体という袋状のカルシウム貯蔵庫がある。小胞体からカルシウムが放出されると筋繊維は収縮し、カルシウムが小胞体に戻ると筋繊維は弛緩する。このカルシウムの移動の積み重ねが筋肉運動となる。ただし小胞体内部は外部の1万倍のカルシウム濃度であり、出すのはたやすいが、戻すのは濃度差に逆らう力仕事だ。小胞体においてカルシウムを汲み上げるポンプもまた膜タンパクである。このカルシウムポンプはアデノシン三リン酸(ATP)の分解によって得られるエネルギーにより駆動されている。
東京大学の豊島近教授の研究チームは、このカルシウムポンプの研究を続けてきた。「目標はカルシウムポンプの原子構造を解明することでした」と豊島教授は語る。研究グループはまず1996年に、カルシウムポンプタンパク質の結晶化に世界で初めて成功した。高性能電子顕微鏡でこの結晶の構造解析を進めたが、ヘリックスの存在が確認できる程度で、原子構造の解明は望むべくもなかった。
ちょうどそのころSPring-8が開設され、豊島教授は、X線回折による解析を試みることにした。1998年秋、構造生物学IビームラインBL41XUにカルシウムポンプの結晶が持ち込まれた。X線の解析には、結晶に厚さが必要だが、当時得ていた結晶は数μmと薄かった。「ただし初回の解析で一定の成果を上げ、厚さが増せば目的は達せるという感触は得ました」と豊島教授。その後、結晶を厚くする研究が続けられ、それにともなってデータの質は高まっていった。
そして2000年6月、0.26 nm(ナノメートル=10-9 m)の高分解能で回折データを集めることに成功し、カルシウム結合時と非結合時のポンプタンパク質の立体構造が解明された。世界初のカルシウムポンプの立体構造図は、英科学誌『Nature』の表紙を飾り、研究成果が詳報された。
続いて2002年8月、研究グループは、カルシウム運搬後のカルシウムポンプの構造を解明した。カルシウムポンプは10本のαヘリックスとA、N、Pの3つの細胞質領域(ドメイン)で構成されているが、桶のように寄り集まったαヘリックスの1本が、結合していたカルシウムを放出するためにピストンのように上下運動をし、カルシウムポンプ全体が大きく動くことがわかった。こんな手押しポンプのような動きは、世界中の科学者の誰も想像していなかった。
豊島教授たちは、2004年までに4段階のカルシウムポンプの構造を解明し(図2)、その詳細が『Nature』で計4回紹介された。類縁の膜タンパクであるナトリウムポンプの発見はノーベル賞に輝いたが、カルシウムポンプの研究成果もそれに匹敵する。この一連の「カルシウムポンプ作動機構の解明」の業績によって、豊島教授は2009年度朝日賞を受賞した。
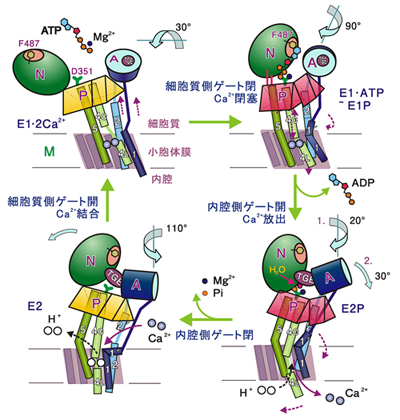
左下:カルシウムがない状態では3つのドメインは寄り集まっている。左上:カルシウムイオンがポンプタンパクに結合するとドメインは開く。右上:NドメインがPドメインに近付き、ATPがNドメインとPドメインを橋渡し、A・Nドメインも結合。またAドメインとM1へリックスがポンプの入り口をふさぐ。右下:Aドメインが回転し、M1へリックスの向きが変わり、M4へリックスの下半分(M4L)が向きを変え、内腔側のゲートが開く。またPドメインが傾斜し、M5へリックスが湾曲し、M3, M4へリックスがピストンのように下がって、カルシウムイオンを押し出す。
細胞間を連結するギャップ結合チャネル
細胞は緻密な連携によって機能している。例えば心筋細胞どうしが歩調を合わせることで心臓は規則正しく拍動する。この連携の要となるギャップ結合チャネルも膜タンパクである。なんとギャップ結合チャネルは、2つの細胞を高架橋のように直接連結しているのだ。
2007年に京都大学のグループが、チャネルの閉じた状態の構造を電子顕微鏡によって確認したが、開いた状態の構造をSPring-8のX線結晶構造解析法で解明したのが兵庫県立大学の月原冨武特任教授(大阪大学名誉教授)の研究グループだ。「ギャップ結合チャネルは鼓に似た形をしており、分子の長軸に沿って約1.4 nmの空洞があり、小さな分子やイオンが透過できるようになっていたのです」と月原教授は語る。
閉じた状態ではチャネル孔上部に構造体が見られ、これがチャネルをブロックしていると推測されたが、開いた状態ではチャネル孔上部に短い6つのαヘリックスが漏斗状の構造をつくり、チャネルをふさぐ存在はなかった(図3)。
研究の成果は2009年4月に『Nature』に掲載された。ギャップ結合チャネルを構成するタンパク質は人間で20種類以上が見つかっており、類似した構造をもつ変異体が多くの疾患の原因となっていると考えられ、構造解明によって有効な治療法が得られることが期待されている。
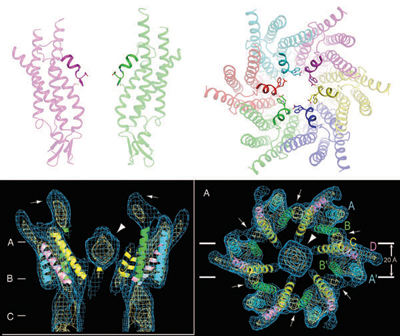
開いた状態ではチャネル孔の上部に短い6つのαへリックスからなる漏斗状の構造が確認され、チャネルの透過経路にはこれを塞ぐようなものは見られなかった。(下図はA. Oshima et al., Proc. Natl. Acade. Sci. USA 2007 104(24), 10034-10039.より引用)
- 目次に戻る
- 次のページ
Topic 2 高分子複合体の結晶構造解析 - 前のページ
ライフサイエンス /生命の謎を分子レベルで解明する