Topic 3 X線小角散乱法による時計タンパク質の実時間解析
シアノバクテリアの「生体時計」が時を刻む機構を解明する
地球上の生命体の多くは精巧な生体時計を備えており、私たち人間も生体時計を貴重な指針として活動している。生物は、時計が刻む24時間周期の概日リズムを指針に、代謝や光合成といった重要な生命活動を繰り返しているのだ。この生体時計を担う分子は時計タンパク質と総称されるタンパク質群であり、多様な生物を用いてその研究が行われている。SPring-8の高輝度X線は、生体時計を備えたもっとも下等な生物シアノバクテリアを用いて、従来不可能とされてきた時計タンパク質が時々刻々変化する様の可視化を可能とした。この成果は生体時計と病気の関係をはじめ、生体時計の基礎研究に新しい境地を開くことになる。
「時計」の原理は3種のタンパク質の離合集散
シアノバクテリアで時計機能を担うのは「Kai(カイ)」と呼ばれるタンパク質である。Kaiタンパク質にはKaiA、KaiB、KaiCの3種があり、時計の振り子に相当するのがKaiC。その状態はKaiAやKaiBとの相互作用で変化する。
この相互作用においてはアデノシン三リン酸(ATP)が重要な役割を担う。ATPは生物がエネルギーを保存・活用するために不可欠な物質で「エネルギー通貨」とも称される。アデノシン二リン酸(ADP)がATPになることでエネルギーが蓄積され、逆にATPがADPになることでエネルギーを発生する。このときタンパク質によってはATP由来のリン酸が付加されるリン酸化という現象が起こる。
シアノバクテリアでは、KaiAがKaiCのリン酸化を促し、KaiBがKaiAの働きを抑制することでKaiCの脱リン酸化を促している。ATPをエネルギー源とし、リン酸化と脱リン酸化によってKaiCは「振動」しているのだ。たった3種のタンパク質が時を安定的に刻むというのは驚くべき生命現象である。
この驚異のメカニズムを解明するためには、Kaiタンパク質の構造を明らかにしなければならない。すでに個々の立体構造は判明しているが、結合した複合体構造は把握できていない。複合体は一定の結合状態を保っているのではなく、時々刻々大きさ・形を変化させるからだ。この離合集散は、静的な観察ではとらえることはできず、従来の構造生物学的手法には限界があった。
KaiAとKaiBの巧みなコンビネーション
2005年10月、SPring-8の理研構造生物学ビームラインI(BL45XU)を使い、この難題に挑むプロジェクトを開始したのが科学技術振興機構(JST)の秋山修志さきがけ研究者(現・名古屋大学講師)、理化学研究所の前田雄一郎主任研究員(現・名古屋大学教授)たちの研究グループだった。
まずKaiA、KaiB、KaiCをATPと混合し、振動反応を開始させる。これが時刻0時の段階だ。3時間ごとに一定量の試料を反応溶液から抽出し、その一部で「ATPとの結合によってリン酸化されたKaiCの割合」を定量する。
そして残りの試料はBL45XUに持ち込み、72時間、X線小角散乱によって計測した。X線小角散乱とは、X線を照射して散乱するX線のうち、散乱角が小さいものを測定することにより構造情報を得る手法で、数nm(ナノメートル=10-9 m)レベルの構造解析が可能だ。散乱したX線はX線用カメラで画像化され、ここから散乱X線の強度・角度分布などを読み取り、それに合致する部品配置を調べる。
測定の結果、入射ビームと同方向に散乱されたX線の強度(原点散乱強度)は約24時間の周期で力強く振動していた。この結果は、Kaiタンパク質が溶液中で離合集散を繰り返していることを示すものだ。さらにKaiCのリン酸化状態も24時間周期で振動していることが確認された(図1)。「興味深いのは、KaiCのリン酸化状態が、試料の重量平均分子量の増減よりも1/4周期進んでいる点でした。この位相差の原因を突き止めるため、KaiAやKaiBを欠損した系について同様の実験を行いました」と秋山講師。
その結果、KaiCと相互作用を及ぼし合うタイミングがKaiAとKaiBでは大きく異なっていることが判明した。両者のふるまいは次のようなものだ。まず3つのKaiタンパク質を混合すると、KaiAは速やかにKaiCに結合し、性急にKaiCをリン酸化する。KaiBはリン酸化が終了した後にKaiCと結合し、ゆっくりと脱リン酸化し、やがてKaiCから離れる。このように俊敏に機能するKaiAとゆっくり機能するKaiBのコンビネーションが位相差を生むのだ。
さらに研究グループは、X線小角散乱測定の情報をもとに離合集散の過程で発生するKaiA・C複合体やKaiB・C複合体の分子形状を調べ、その具体的な構造を解明した(図2)。KaiA・C複合体のサイズは15×15×11 nmだった。KaiCは全体積の80%を占め、球状の頭部と短い尾部から構成されており、頭部の中心には空洞が存在していた。
KaiCの頭部はさらにC1とC2と呼ばれるドメインに分割され、KaiAに相当する残り20%の電子密度はC2ドメインと尾部の近くに局在していることがわかった。一方、KaiB・C複合体は14×13×10 nmで、KaiA・Cよりやや小さい。KaiA・C同様にKaiCに特徴的な形状を確認することができ、全体の13%の体積を占めるKaiBはC2ドメインに作用していると判断できた。
X線小角散乱で調べたこれらの分子形状は、すでに他の研究グループによって発表されていた個々のKaiタンパク質の結晶構造と矛盾することなく、部品配置はスムーズに進んだ。そして秋山研究者たちは、シアノバクテリアの生体時計の結晶構造に関して、それまでに得てきた情報をもとに分析し、2008年3月に論文を発表した。
こうして研究グループは世界で初めて、離合集散するKaiタンパク質の動態を可視化できるレベルまで解析した。
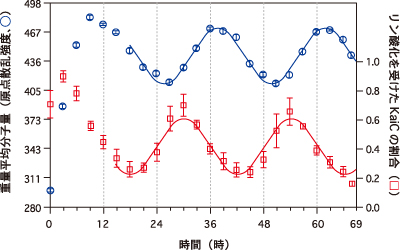
左軸には、前方に散乱されたX線の強度(原点散乱強度)から見積もった試料の重量平均分子量を、右軸には、同時刻に定量したリン酸化を受けたKaiCの割合(リン酸化状態)がプロットされる。リン酸化状態のほうが重量平均分子量よりも1/4周期進んでいる。
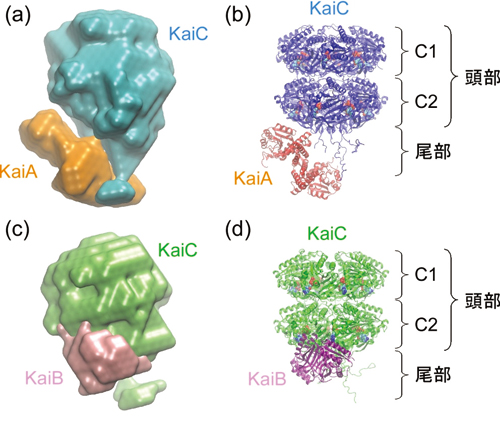
KaiAとKaiBは、KaiCのC2ドメインから尾部と相互作用を形成している。
「時計のペースメーカー」の正体
「可視化以上に重要な成果は、どの歯車が時を刻むためのペースメーカーになっているかが読み取れた点です」と秋山講師は語る。ではペースメーカーはどれなのか。
研究グループが注目したのは、リン酸化を受けるアミノ酸がKaiCのC2ドメインに局在しており、KaiAやKaiBとの相互作用もC2ドメインと尾部で起こっている点だ。この事実は、KaiCが自身のリン酸化状態に応じてC2ドメインから尾部の構造を変化させ、KaiAやKaiBを呼び寄せたり、突き放したりしてタイミングを制御していることを意味する(図3)。KaiAやKaiBに動かされているように見えるKaiCがペースメーカーだったのだ。
では、なぜKaiCは、そのように正確なペースを保つことができるのか。これを知るためには、KaiCの構造変化を溶液中で明らかにする必要がある。X線小角散乱法という武器を得た研究グループは、今後、KaiCがペースメーカーとしての機能を発現する機構を解明していくことになる。そしてやがて私たち人間の生体時計のメカニズムも解明されることが期待される。それが実現すれば、生体リズムの不調に由来する睡眠障害の画期的な治療法の確立も夢ではなくなる。
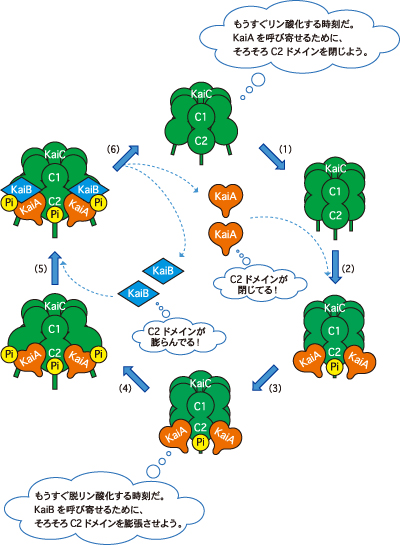
KaiAはオレンジ色のハート、KaiBは青色のひし形、KaiCは緑色の樽、リン酸は“Pi”として模式的に表示されている。(1)KaiAを呼び寄せるため、KaiCはC2ドメインを構造変化。(2)KaiAがKaiCに結合。(3)KaiCがリン酸化される。(4)KaiBを呼び寄せるため、KaiCはさらにC2ドメインの構造を変化。(5)KaiBがKaiA・C複合体に結合。(6)KaiCが脱リン酸化され、KaiAやKaiBがKaiCから解離。