生物時計の振動発生に関わるタンパク質の構造を解明- 生物時計の分子メカニズムの解明に新たな知見 -(プレスリリース)
- 公開日
- 2004年05月31日
- BL26B1(理研 構造ゲノムI)
- BL26B2(理研 構造ゲノムII)
平成16年5月31日
独立行政法人理化学研究所
国立大学法人名古屋大学
|
独立行政法人理化学研究所(野依良治理事長)は、国立大学法人名古屋大学と共同で、光合成を行う最も下等な生物である藍(らん)色細菌について、生物時計の発振に関わる時計タンパク質KaiA(カイ・エー)の立体構造を、大型放射光施設(SPring-8)の理研構造ゲノム I ビームラインBL26B1および理研構造ゲノム II ビームラインBL26B2を用いて明らかにし、世界で初めて、時計タンパク質の立体構造に基づいた生物時計の分子機構を原子レベルで解明することに成功しました。この研究成果は、名古屋大学遺伝子実験施設の宇津巻竜也研究員、藤田真康大学院生(理研研修生)、石浦正寛教授、理研播磨研究所メンブレンダイナミクスグループの中津亨研究員(京都大学大学院薬学研究科助教授)、柴田洋之研究員、加藤博章チームリーダー(京都大学大学院薬学研究科教授)らの研究グループによるものです。名古屋大学の研究は、主に独立行政法人生物系特定産業技術研究支援センターの「新技術・新分野創出のための基礎的研究推進事業(PROBRAIN)」により支援されました。 (論文) |
1.背景
地球上に生息する多くの生物は、地球の自転により生じる24時間周期の昼夜交代に伴い、体内の様々な活性を自律的に変動させます。この約24時間周期の変動は、一定環境下でも継続する自律的振動であり、この振動を発振させる仮想的な細胞内機構が生物時計*1です。現在までに様々な生物で生物時計の研究が行われ、いくつかの時計遺伝子*2、時計関連遺伝子*2が発見されましたが、それらの遺伝子による24時間周期の発振の分子機構は未解明のままです。
機械式の時計では、ゼンマイや振り子、歯車などが決まった順序と位置関係で正しく機能することによって、正確な時を刻むことができます。同様に、生物時計もこうした部品の役割を果たす時計タンパク質*2や時計関連タンパク質*2が、各々の役割を適切な時間に適切な組み合わせで果たすことで、正確な時を刻むものと考えられます。すなわち生物時計は、タンパク質という生体部品によって構成される精巧な分子機械だと考えることができます。したがって、時計タンパク質の形や機能を原子レベルで解明することが、生物時計の分子機構を解明する手掛かりになります。
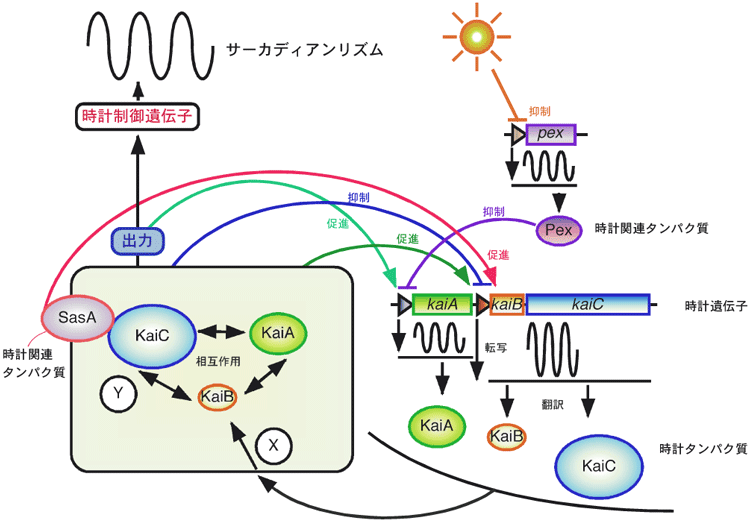
藍色細菌*3は、生物時計の存在が知られているもっとも下等な生物です。藍色細菌では、時計遺伝子クラスター*4 kaiABCが生物時計の本体の遺伝子です。時計遺伝子クラスターkaiABCは2つのオペロン*5より構成されており、kaiBCオペロンの発現は、時計タンパク質KaiAにより促進され、もう一つの時計タンパク質KaiCにより抑制されます。この様に、時計遺伝子の発現が自分自身の発現産物である時計タンパク質で制御されるフィードバック制御*6こそが、時計の発振の本質であろうと考えられています(図1)。また、KaiA、KaiB、KaiCは、どんな組み合わせでもタンパク質複合体を形成することができます。KaiCのリン酸化*7はKaiAによって促進されます。しかしながら、KaiA、KaiB、KaiCがどの様な形をしており、どの様な生化学的機能を発揮することで時計の発振を実現しているかは分かっていません。そこで、私たちはまず時計タンパク質の原子レベルでの構造を解明して、生物時計装置の働くしくみを明らかにするための糸口をつかむことを狙いました。
2.研究手法と成果
現在11種の藍色細菌で、時計遺伝子kaiAが見つかっています。比較遺伝学*8の見地から、KaiAは3つのドメイン*9から構成されることが予想されました。そこで欠失マッピング法*10を用いることにより、リズムの振幅を増強するN末端の振幅増幅ドメイン、周期を約24時間に調節する中央部の周期調節ドメイン、時計の発振を司るC末端の時計発振ドメインの、3つのドメインから構成されることが明らかになりました。また、時計の発振そのものに必須な機能は、全てC末端時計発振ドメインに局在していました。
X線結晶構造解析によりタンパク質の立体構造を決定するためには、タンパク質を高純度に精製し、結晶化する必要があります。そこで、研究チームは耐熱性が高い別府温泉産の好熱性藍色細菌Thermosynechococcus elongatus BP-1株由来のKaiAおよび各ドメインに分けたKaiAを用いて結晶化を行いました。その結果、C末端時計発振ドメインについて、1.8Å*11という高い分解能でのX線結晶構造解析に成功しました。その際、SPring-8の高性能なX線を用いた多波長異常分散法*12の利用が解析実現のカギとなりました。
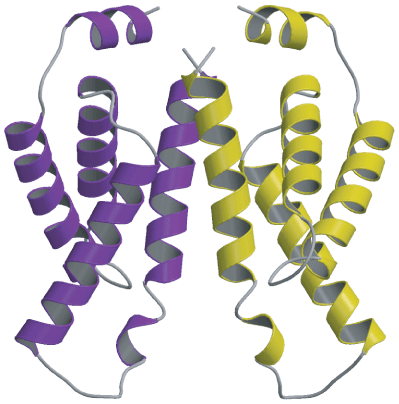
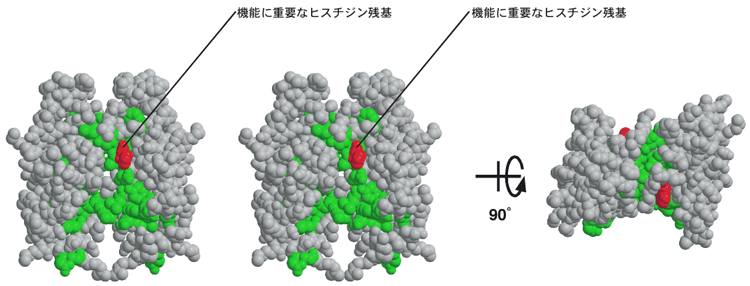
構造は主にα-ヘリックス*13構造で構成されていました。KaiAにおけるC末端時計発振ドメインの全体構造は二量体*14(図2)であり、凹レンズ状の構造でした。凹面のほぼ中央に位置する270番目のヒスチジン残基は、その側鎖をKaiA分子の外側に伸ばしており、何らかの機能を担っていると予想されました(図3)。そこで、このヒスチジン残基をアラニン残基に置換した変異体を作製したところ、変異型KaiAではKaiCとの結合能やKaiCリン酸化促進能が著しく低下し、生物時計は全く発振しなくなりました。この結果より、このヒスチジン残基がKaiAの時計発振機能に必須であることが明らかになりました。また、KaiAは、二量体になることよって形成される凹面を介してKaiCと結合することが予想されました。
KaiAには、現在までに生物時計の周期や振幅に影響を与える多数の変異が報告されています。今回決定した立体構造に基づいてこれらの変異を解析した結果、構造に大きく影響を与える変異は、リズムに大きな影響を与えて無周期や長周期、低振幅などを引き起こし、構造にあまり影響を与えない変異は、時計の発振自体にはほとんど影響を与えず、わずかに周期が延長されるのみであることが分かりました。
3.今後の展開
今回の成果により、KaiAにおけるC末端時計発振ドメインの立体構造と機能との関係を、原子レベルで解明することができました。
今後、さらに生物時計装置の分子機構について、原子レベルでの解明を進めたいと考えています。他の時計タンパク質であるKaiBやKaiC、およびKaiAとこれらとの複合体や各存在状態におけるX線結晶構造の解明、各タンパク質における機能残基の推定、藍色細菌の変異体作製による変異タンパク質の調製、試験管内での生化学的機能と細胞内でのリズム機能の解析などを行う予定です。また、それぞれのKaiタンパク質が細胞内においていつ、どの場所に存在しているのか、Kaiタンパク質の複合体がいつ、どの場所で形成され、あるいは解離しているかを解明することも重要です。生物時計の分子機構には、解明すべき点がまだ多く残されています。今回明らかにしたKaiAの立体構造とそれに基づいた解析は、今後の生物時計装置における原子レベルでの研究に、新しい方向性を示したといえます。生物時計装置の解明により、生体リズムの不調による不眠症などの治療、植物の発生や成長を制御することによる生産性の向上などが可能になると考えられます。
<参考資料>
時計遺伝子産物(時計タンパク質)が自身の遺伝子の発現を制御するフィードバックループを形成している。
緑色は11種の藍色細菌で保存されている残基を、赤色は生物時計機能に必須な270番目のヒスチジン残基を示している。このヒスチジン残基をアラニン残基に置換したところ、KaiCとの結合能やKaiCリン酸化促進能は著しく低下し、生物時計は全く発振しなくなった。
<補足説明>
- ※1 生物時計
地球上に生息する多くの生物は、地球の自転により生じる24時間周期の昼夜交代に伴い、体内の様々な活性を自律的に変動させます。この約24時間周期の変動は、一定環境下でも継続する自律的振動であり、この振動を発振させる仮想的機構が生物時計です。
- ※2 時計遺伝子、時計タンパク質、時計関連遺伝子、時計関連タンパク質
生物時計の中核機能に関与する遺伝子を時計遺伝子、その翻訳産物を時計タンパク質と呼びます。時計の本体ではありませんが、時計の入力系、出力系など、生物時計の制御に関わっている遺伝子を時計関連遺伝子と呼びます。その翻訳産物が時計関連タンパク質です。私たちは、生物時計装置は時計タンパク質の複合体であると考えています。なお、藍色細菌の時計遺伝子kaiの名前は日本語の「回転」に由来します。
- ※3 藍色細菌
シアノバクテリアとも言います。藍色細菌は原核生物であり、真正細菌の一種です。約30億年前(35億年前という説もある)に地球上に出現し、光合成によって酸素を産生した最初の生物であると考えられています。海洋や湖沼、河川や土壌中など、比較的身近に見られる生物です。
- ※4 遺伝子クラスター
複数の遺伝子が非常に狭い範囲に並んでいること。
- ※5 オペロン
遺伝子発現において、同一のプロモーターによって発現調節を受けている一連の遺伝子群のこと。多くの場合、同一オペロンに属する遺伝子群は機能的にお互いに関連しています。
- ※6 フィードバック制御
工学の概念で、入力量が出力量で制御される制御のこと。
- ※7 タンパク質のリン酸化
生体内のタンパク質は、酵素の働きでリン酸化(リン酸基が付加されること)されることにより、その機能活性が変化するものがあります。すなわち、リン酸化の有無によって、非常にたくさんのタンパク質の働きが調節されています。
- ※8 比較遺伝学
ゲノム配列を初めとする各種の遺伝情報を、異なる生物種間で比較してそれぞれの生物種に特有なもしくは普遍的な形質を解析する学問のこと。遺伝配列の情報が世に多く現れるようになった近年、注目を集めています。
- ※9 ドメイン
タンパク質の構造上、あるいは機能上の小区域または単位をドメインと呼びます。
- ※10 欠失マッピング法
タンパク質のドメインの機能を決定する方法の一つ。複数のドメインから構成されるタンパク質において、各ドメインがそれぞれ欠失した変異タンパク質を調製し、その活性を解析することで各ドメインの機能を決定します。
- ※11 Å(オングストローム)
長さの単位。1オングストローム = 1 x 10-10メートル(= 0.1ナノメートル)。タンパク質の立体構造解析においては、解析した構造の分解能を表す単位として用いられ、数字が小さい程より精度の高い解像度の立体構造であることを示しています。
- ※12 多波長異常分散法
X線の波長を変えられる放射光を使って、波長に依存した原子のX線散乱の変化に基づいて解析する方法。これまでは、原子量の大きい金、白金、水銀などでラベルした質のよい結晶が複数種必要でしたが、多波長異常分散法ではただ一つのラベルされた結晶を使った解析が可能になります。ただし、これによって測定できる信号は微小なため、これまでの方法より数段も精度の高い測定が必要となります。
- ※13 α-ヘリックス
β-シートと並んで、タンパク質のアミノ酸鎖がとる堅固な構造の一つで、一種のらせん構造。α-ヘリックスやβ-シートなどはタンパク質の二次構造と呼ばれ、タンパク質の立体構造を構成する基本構造です。
- ※14 二量体
タンパク質が2本のポリペプチド鎖(アミノ酸が鎖状につながったもの)から構成される場合、そのタンパク質は二量体であると言います。また、各々のポリペプチド鎖のことをサブユニットと呼びます。KaiAでは、同一のサブユニット2つからなる二量体が形成されることで、機能を持つ構造(機能構造)になります。
|
<本件に関する問い合わせ先> 独立行政法人理化学研究所 播磨研究所 独立行政法人理化学研究所 播磨研究所 (報道担当) <SPring-8についての問い合わせ先> |
- 現在の記事
- 生物時計の振動発生に関わるタンパク質の構造を解明- 生物時計の分子メカニズムの解明に新たな知見 -(プレスリリース)