タンパク質分子に変異導入し、結晶の品質が改善-結晶解析が困難なタンパク質を駆逐する、タンパク質結晶工学の確立に一歩前進- (プレスリリース)
- 公開日
- 2008年09月29日
- BL26B1(理研 構造ゲノムI)
2008年9月29日
独立行政法人理化学研究所
本研究成果のポイント
○部位特異的変異で難解析性タンパク質の結晶品質が改善
○変異導入した古細菌タンパク質で、分解能の大幅向上を実証
○高分解能化により、安全で高効果の医薬品開発がスピードアップ
|
独立行政法人理化学研究所(野依良治理事長)は、タンパク質分子への変異導入により、タンパク質結晶の品質を計画的に改善する「タンパク質結晶工学」の先行技術を世界に先駆けて実現しました。理研放射光科学総合研究センタータンパク質結晶構造解析研究グループ(石川哲也センター長兼グループディレクター)の水谷尚志研究員および国島直樹グループ副ディレクターらによる研究成果です。 (論文) |
1.背 景
世界中で行われている構造ゲノムプロジェクトにより、膨大な数のタンパク質立体構造が決定されました。現在、最も構造解析の進んでいる生物は、高度好熱菌Thermus thermophilus HB8※8で、全2,200種のタンパク質のうち2割の立体構造が決定されています。しかし、その半面、現在の技術では、解析困難なものばかりが8割残されました。一般に膜タンパク質や超分子複合体など難解析性タンパク質と呼ばれるものは、分子表面の疎水性や分子構造の不安定性などの理由で、良質の結晶が得られない場合が多くあります。このため、今後、難解析性タンパク質の構造決定を推進するにあたって、結晶の品質改善が、避けて通ることができない最も重要な問題となっています。研究グループでは、この問題に対する答えとして、試料タンパク質分子中の結晶パッキングにかかわるアミノ酸残基への部位特異的変異導入を検討しています(図1)。
このアミノ酸残基に部位特異的変異を導入する手法は、これまでも多く試みられてきました※9。これらの変異体実験で得られた結晶構造では、ほぼ例外なく変異を導入した部位が結晶パッキングを形成していました。このことは、一般に結晶パッキング部位が結晶の原子レベルの規則性を決定する主要な分子間相互作用を担っていることを示唆しています。このため、もともと存在する結晶パッキング部位を変異導入によって適切に改変することで、タンパク質結晶の品質を改善することが原理的に可能となります。しかし、これまでに報告された方法では、結晶パッキング部位を直接狙って変異導入を行なっていないため、変異導入後に、新たに結晶化する条件をスクリーニングする必要があり、構造が違う別のタンパク質を従来の方法で構造解析することと変わりません。解析できないタンパク質結晶を、パッキング様式を保ったまま結晶パッキング部位を改変するだけで、結晶解析が可能なレベルまで品質改善をすることができると、新たな結晶化条件のスクリーニングは必要ないと考えられます。しかし、これまでは適切な実験系がなかったため、このような試みはなされていませんでした。
2.研究手法と成果
研究グループでは、タンパク質の分子表面の結晶パッキング部位にかかわるアミノ酸残基に変異を導入し、分子間の接触を改良することで、結晶化条件を変えることなくタンパク質結晶の分解能を向上することを目的とした研究を行いました(図1)。この種の研究では、実験系の選定が鍵となります。同グループでは、すでに超好熱古細菌Pyrococcus horikoshii OT3由来Diphthine synthase (PhDS) ※10の結晶構造を2.1Å(オングストローム、100億分の1メートル)分解能で決定する成果を得ています(図2)。このPhDSは、以下のような理由で、網羅的な変異導入により、どのように結晶の質が影響を受けるかを調べるのに格好の材料であるといえます。(1)分子量6万程度とタンパク質として中程度の大きさを持ち、一般的なタンパク質の代表としてふさわしい(2)何も変異を加えていない野生型結晶の分解能は2.1Åと中程度であり、分解能の変化を研究するのに都合がよい(3)ほとんどの変異体において大量の試料を安定して調製できる(4)1つの結晶型が非常に安定して析出し、変異導入により空間群が変化したりすることがない。
研究グループでは、PhDSの野生型結晶構造にもとづいたコンピューターグラフィクス上でのモデリングにより、結晶パッキング部位に新たな相互作用が形成可能な変異体候補を21種類設計しました(図3)。これらの変異タンパク質を発現・精製し、すべての変異体において野生型と同じ結晶化条件を用いて結晶化をしました。得た21種類の結晶はすべて同じ空間群に属し、大局的に野生型結晶と似た格子定数を保っていましたが、有意な構造の違いがあり、分解能にも明らかな差が認められました。そこで、大型放射光施設SPring-8の放射光(理研構造ゲノムビームラインBL26B1)を用い、すべての変異体結晶の大規模構造決定を行いました。その結果、8種の変異体においてこれまでの分解能(2.1Å)よりも改善し、1.8Åより高分解能化した結晶を得ることができました(図4)。最も分解能が改善した上位3つの変異体はK49R(1.5Å)、T146R(1.6Å)、N142E(1.75Å)の3種でした。これらの結果により、結晶パッキングにかかわるアミノ酸残基への変異導入が、実際にタンパク質結晶の品質を改善できることを、実験的に証明したことになります。
各変異体結晶の構造解析結果をみると、変異により新たな分子間相互作用が築かれたものでは、野生型よりも分解能が向上したと解釈できます。しかし、変異を導入したアミノ酸残基から遠い部位が、野生型と比べて構造変化した場合も多くあり※11、変異導入による分子間相互作用の変化と分解能の因果関係を客観的に評価することは、個々の構造を見る限り容易ではありません。そこで、得た変異体タンパク質結晶の分解能と構造変化などの関連性を統計学的手法で分析しました。その結果、パッキングによるタンパク質分子間の接触面積が野生型と比べて大きくなると、結晶の分解能が向上する傾向があることが明らかとなりました(図1)。また、分解能が著しく向上する変異体では、上述の通り、野生型と比べて特に大きな構造変化を示す傾向があることもわかりました。ただし、大きな構造変化といっても、野生型および変異型タンパク質分子を対応するアミノ酸残基(α炭素原子)で重ね合わせた場合の平均二乗偏差(root-mean-square deviation)で0.3Å程度の変化であり、タンパク質の機能を破壊してしまうほど大きな変化ではありませんでした。
3.今後の期待
今回の研究で、タンパク質分子における結晶パッキングに関与するアミノ酸の1残基を適切に変異させるだけでタンパク質結晶の分解能は向上可能であることがわかりました。低分解能の結晶構造が得られている場合、この方法を適用することで、タンパク質結晶の品質を計画的に改善することができます。今回の変異導入によるタンパク質結晶の品質改善法は、「タンパク質結晶工学」確立の第一歩として行ったものです。研究グループでは、タンパク質結晶工学を目指したほかの試みとして、タンパク質結晶化を計画的に制御するタンパク質結晶化触媒※12の開発も行っています。これらの技術を相補的に適用することで、難解析性タンパク質の構造解析に革新をもたらすことと注目されます。
今回の研究では、結晶品質の著しい改善のためには平均二乗偏差で0.3Å程度の構造変化が必要なこともわかりました。この程度の構造変化は、事前のモデリングでは予測困難である複雑なパッキング相互作用変化を引き起こします。従って、今回開発した変異導入による品質改善法の適用範囲をさらに広げるためには、モデリングの予測精度を高めるとともに、結晶パッキング部位を実験的に検出する方法や、よい結晶を与える変異体を実験的にスクリーニングする方法などの開発が必要となります。今後はこれらの方法を模索すると共に、得られた結晶構造をエネルギー計算などにより、さらに詳細に分析する予定です。その結果、放射光を使った難解析性タンパク質の構造解析が進み、難病の原因究明や創薬のスピードアップに大きく貢献するものと期待されます。
《補足説明》
※1 構造ゲノムプロジェクト
タンパク質の立体構造は、生物を原子レベルで理解するために不可欠な情報である。生物の全遺伝子(ゲノム)を多種類の生物について解読するゲノミクスが実現した後、それらのゲノムがコードするタンパク質の立体構造を網羅的に決定し、立体構造に基づく研究開発の基盤として役立てようとする大規模な研究プログラムが世界的に進められている。この学問分野を構造ゲノミクスという。日本では2007年3月までの5年間「タンパク3000プロジェクト」と呼ばれる構造ゲノムプロジェクトが国家プロジェクトとして実施され、多数の構造決定が行われるとともに、効率的な構造解析のためのインフラが整備された。
※2 膜タンパク質
膜に組み込まれて機能するタンパク質のこと。膜タンパク質は、生体内において、脂質でできた細胞膜という2次元の物質中に存在しており、結晶という3次元構造へ変化させるために必要な試料調製や結晶化には、特殊な発現系や界面活性剤処理など、高度な技術が求められる。膜タンパク質は、最も重要な創薬ターゲットであるGタンパク質共役型受容体(GPCR)に代表される、医学的・生物学的に重要なものを多く含むが、解析困難なためほとんど構造が決定されていない。世界で初めて膜部分を含む全体構造が決定されたGPCRであるロドプシンの結晶構造解析は、SPring-8を使った成果である。
※3 超分子複合体
多種類のタンパク質が会合して巨大な複合体をつくることで、初めて機能を発揮するタンパク質複合体のことで、プロトンポンプやリボゾームなどが例としてあげられる。不安定で試料の調製や結晶化が難しく、解析困難なものがほとんどである。
※4 部位特異的変異
遺伝子操作により、目的タンパク質の特定のアミノ酸残基を任意の別の種類のアミノ酸に置換することができる。この技術でタンパク質に導入した突然変異を部位特異的変異という。
※5 結晶パッキング
タンパク質結晶は、タンパク質分子が3次元的に原子レベルの規則性を持って整列してできており、結晶内のタンパク質分子同士の接触を結晶パッキングと呼ぶ。パッキング部位の構造は結晶中で最も自由度の高い部分であるため、タンパク質結晶のX線回折能(分解能)は結晶パッキング領域の規則性に大きく依存すると考えられる。従って、結晶パッキングにかかわるアミノ酸残基を部位特異的変異で適切に改変することにより、タンパク質結晶の品質を改善することが可能なはずである。しかし、適切な実験系がないためこれまで系統的な検討がなされていなかった。変異導入によってタンパク質の本来の構造が壊される可能性があるという考え方もあるが、立体構造がわからなければ目的タンパク質の構造機能相関の議論は困難となり、従って関連医薬品などの開発もまた難しくなる。研究グループは、一度立体構造を可視化することができると機能に重要な部位の推定などが可能となり、その情報に基づいたさらなる構造解析および機能解析を行うことによって目的タンパク質の本来の構造機能相関を解明することができると考え、本研究開発を行っている。
※6 古細菌
ヒトを含む真核生物、バクテリアなどの原核生物と並ぶ、生物の第3のグループ。温泉の源泉など、通常の生物では生体物質が熱で変性してしまうために生きられないような環境に好んで生息する。これらから抽出したタンパク質は熱に強く、実験を行う上で都合がよいため、タンパク質研究によく用いられる。今回の研究対象タンパク質であるDiphthine synthaseは、タンパク質の生合成に関与する超好熱古細菌Pyrococcus horikoshii OT3由来の酵素で、ヒトにも存在する。
※7 大型放射光施設SPring-8
理研が所有する、兵庫県の播磨科学公園都市にある世界最高の大型放射光施設。SPring-8の名前はSuper Photon ring-8GeVに由来する。放射光(シンクロトロン放射)とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げたときに発生する、細く強力な電磁波のことである。
※8 高度好熱菌Thermus thermophilus HB8
静岡県伊豆半島にある峰温泉から発見された、85℃という極限環境で生育できる細菌(バクテリア)で、遺伝子2,200種類という比較的コンパクトなゲノムを持つ。また、構成タンパク質が熱に強く、実験を行う上で都合が良いため、構造ゲノミクスにおけるモデル生物の1つとされる。
※9 これまでに報告された関連技術
初期の有名な変異導入成功例としてヒトH-chain ferritinの結晶構造解析がある(Lawson et al. (1991) Nature 349, 541)。それ以前に構造決定されていたネズミやウマのL-chain ferritinの結晶構造では、分子間にカドミウムイオンを挟むことで良好な結晶パッキング部位を形成していた。同様のパッキングを形成するためにヒトH-chain ferritinの対応する部位にL-chain ferritinの場合と同じアミノ酸への変異導入(K86Q)を行ったところ、初めて解析に適した結晶が得られ構造決定に成功した。最近では、単量体タンパク質の分子表面残基にシステイン変異を導入して強制的に分子間ジスルフィド架橋による2量体を形成させ新たなパッキング様式を持った結晶を得る手法(Banatao et al. (2006) PNAS 103, 16230)、分子表面のαへリックス上の数残基にロイシン変異を導入して結晶パッキング上に人工的なロイシンジッパーを形成させ結晶化を促進する手法(Yamada et al. (2007) Protein Sci. 16, 1389)などが報告されている。しかし、これらの方法は一般的にすべてのタンパク質に適用できるものではない。これまでのところ最も汎用性があり理論的背景も解明されている方法としてSurface Entropy Reduction(SER)法がある(Cooper et al. (2007) Acta Cryst. D 63, 636)。しかしこのSER法では変異導入のパターンが限られていて適用範囲が狭い上、変異体の結晶を作成する際、スクリーニングをする必要があり、計画的なタンパク質結晶工学とは必ずしもいえない。
※10 Pyrococcus horikoshii OT3由来Diphthine synthase (PhDS)
超好熱古細菌Pyrococcus horikoshii OT3に存在する、タンパク質生合成に関与する酵素の1種。PhDSは1サブユニットあたり265残基からなり、生体内では2量体を形成して働く。研究グループはまず野生型PhDSの結晶構造を2.1Å分解能で決定した(Kishishita et al. (2008) Acta Cryst. D 64, 397)。結晶の非対称単位に1つの2量体が存在する。その後、タンパク質結晶工学のモデル系としての価値が見いだされ、PhDS変異体の網羅的な構造解析が行われた(Mizutani et al. (2008) Acta Cryst. D 64, 1020; 本研究)。
※11 変異を導入したことによる構造変化
変異導入候補はグラフィクス上で野生型結晶構造のアミノ酸を仮想的に変換することで検討し選択した。従って、変異導入個所以外の構造は野生型から変化しないという仮定の下で行っている。分解能が向上した変異体のうち、狙い通りに変異個所でのみ局所的にパッキング相互作用が増えたものもあったが、分解能はせいぜい1.75Å(N142E変異体)だった。これに対し、1.5Å(K49R変異体)や1.6Å(T146R変異体)など最高分解能を記録したものでは、変異個所のみの局所的なパッキング相互作用増加にとどまらず、変異の影響が波及してタンパク質分子のさまざまな個所が複雑な構造変化を起こした結果、パッキング相互作用の大幅な改善を達成していた。これは事前のモデリングでは予測できない複雑な構造変化であった。
※12 タンパク質結晶化触媒
ある特定のパッキングを持つタンパク質結晶の生成を、効果的に促進する物質をタンパク質の結晶化触媒という。研究グループは、結晶性無機化合物である合成ゼオライトが結晶化触媒として働くことを見いだした(Sugahara et al. (2008) Acta Cryst. D 64, 686)。合成ゼオライトは、その表面にタンパク質分子を整列させることでタンパク質の2次元結晶を形成させ、それを核とした層状の結晶成長(ヘテロエピタキシャル成長)によりタンパク質の3次元結晶を生成させると考えられる。難解析性タンパク質を結晶化するための新技術として期待される。
《参考資料》
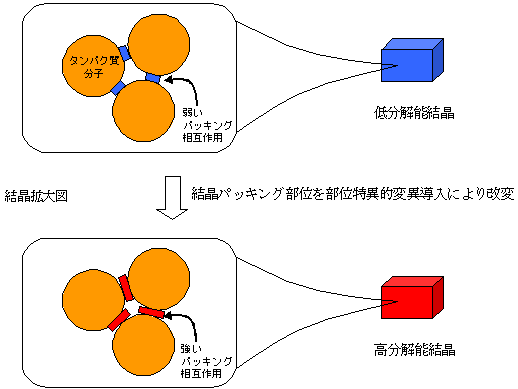 図1 タンパク質結晶の品質改善の概念
図1 タンパク質結晶の品質改善の概念低分解能結晶では結晶パッキング部位における相互作用が弱い。結晶パッキング部位における部位特異的変異導入により結晶パッキング相互作用を強化すると高分解能結晶が得られる。その際、タンパク質分子間の接触面積が増大することが多い。
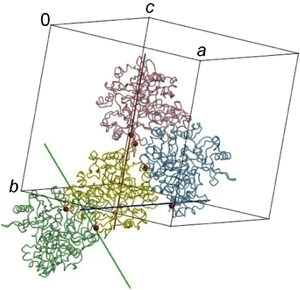 図2 PhDS結晶のパッキング様式
図2 PhDS結晶のパッキング様式 PhDSの結晶は空間群P41212に属し、非対称単位に2量体が1つ存在する。結晶中では、1つの2量体分子が結晶学的な3種の対称操作(41らせん軸(青), 21らせん軸(赤),2回軸(緑))に関連した合計5つの2量体分子に囲まれている。2量体分子表面の18.5%がパッキングにかかわっている。図では各対称軸に関連する3分子を代表して描いた。代表的な変異導入部位を赤点で示した。
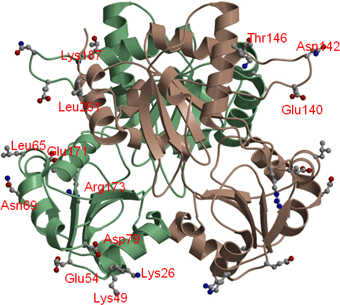 図3 PhDS2量体分子上の変異導入個所
図3 PhDS2量体分子上の変異導入個所今回変異を導入したアミノ酸残基を棒と球体のモデルで描いてある。PhDSは同一のサブユニット2つから成る2量体なので、同じアミノ酸残基が2個所存在する。片方のみに残基名を赤字で示した。変異残基はサブユニットあたり13個所あり、全て結晶パッキングに関与している。異なるアミノ酸残基に変化させた場合を含め21種類の1残基変異体を作成した。
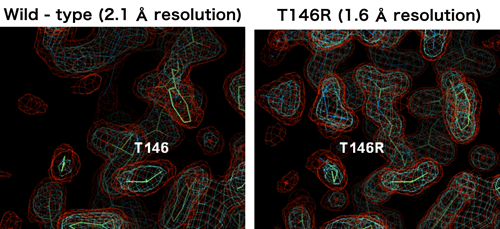 図4 変異導入によるタンパク質結晶の改善
図4 変異導入によるタンパク質結晶の改善結晶パッキングにかかわるアミノ酸残基への変異導入により結晶の分解能改善が可能である(左:野生型2.1Å分解能 右:T146R変異体1.6Å分解能)。どちらも同じ空間群に属し、似た格子定数を持つ結晶である。変異を導入した結晶パッキング部位を同じ方向から見ている。原子の位置を示すかご状の電子密度が、変異体においてよりはっきり見えている。ここでT146R変異体とは、野生型PhDSにおける146番目のスレオニン(3文字表記でThr、1文字表記でT)残基をアルギニン(3文字表記でArg、1文字表記でR)残基に置換してできるPhDS変異体のことを指す。図中白文字でラベルしたアミノ酸残基が146番目のスレオニンおよびアルギニンである。
|
(問い合わせ先) 播磨研究所 研究推進部 企画課 (報道担当) (SPring-8に関すること) |
- 現在の記事
- タンパク質分子に変異導入し、結晶の品質が改善-結晶解析が困難なタンパク質を駆逐する、タンパク質結晶工学の確立に一歩前進- (プレスリリース)