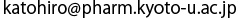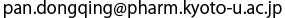ペルオキシソーム病RCDP-1の分子機構の解明(プレスリリース)
- 公開日
- 2013年07月01日
- BL41XU(構造生物学I)
2013年7月1日
本研究成果のポイント
• ペルオキシソーム蛋白質輸送因子と輸送配列の複合体の原子構造を世界で初めて決定しました。
• ペルオキシソーム輸送配列PTS2の認識機構が判明しました。
• 肢根型点状軟骨異形成症1型(RCDP-1)の正確な診断、新たな治療法の開発に分子基盤を提供することができるようになりました。
|
京都大学(総長:松本 紘)の薬学研究科加藤博章教授(理化学研究所客員研究員を兼務)と同研究科潘東青研究員(当時は同研究科の大学院生)らの研究グループは、文部科学省の「ターゲットタンパク研究プログラム」の支援のもと、重篤なペルオキシソーム病である肢根型点状軟骨異形成症RCDP-1の分子機構を解明しました。ペルオキシソームはエネルギー産生のための長鎖脂肪酸の分解など、重要な働きを持つ細胞小器官であり、その形成異常は重篤なペルオキシソーム病を引き起します。RCDP-1型*1はペルオキシソームの構成蛋白質を認識するPex7という輸送蛋白質の機能異常が原因です。本研究ではX線結晶構造解析の手法を用いて、Pex7とその補助因子Pex21が協同してペルオキシソーム構成蛋白質を認識する仕組みを明らかにしました。 |
研究成果の概要
ヒトから酵母まで、真核生物の細胞は細胞小器官と呼ばれる袋構造により様々な機能を分業できるようになっています。細胞小器官には遺伝情報を記録するDNAを格納する核や細胞内のエネルギーを生産するミトコンドリアなどが存在し、中でもペルオキシソームは長鎖脂肪酸を分解し、エネルギー生産に適した物質に変えるなどの働きを持ち、真核生物の生存に重要な細胞小器官です。
ペルオキシソームの内部に化学反応を触媒する酵素を正しく取り込むために、ペルオキシソームの脂質膜上にカギ穴(錠前)付きのゲートが備わっています。ゲートを形作る20数種類の蛋白質のうち、錠前を形成する蛋白質がヒトでは2種類(パン酵母では4種類)存在し、PTS1とPTS2の2種類の輸送配列(カギ)を認識します。これらの輸送配列を認識する蛋白質に異常が生じると、カギとカギ穴が合わなくなるため、酵素がペルオキシソームに入れなくなり、ペルオキシソーム病を引き起こします。
PTS1を認識する蛋白質であるPex5に機能異常が生じると、Zellweger症候群を発症します。一方で、PTS2を認識する蛋白質であるPex7に機能異常が生じると、肢根型点状軟骨異形成症(RCDP)1型を発症します。Pex5によるPTS1の認識機構はすでに2000年にX線結晶構造解析の手法により解明されていました。しかし、PTS2の認識機構については、機能的なPex7を大量に生産することが難しく、X線結晶構造解析を適応することができていませんでした。
今回潘研究員らは、機能的なPex7の大量生産系を確立し、初めてPTS2とそれを認識する蛋白質の複合体の結晶構造を決定することに成功しました。その結果、RCDP-1型の原因蛋白質であるPex7がどのようにPTS2を認識するのかを明らかにしました。
研究手法と成果
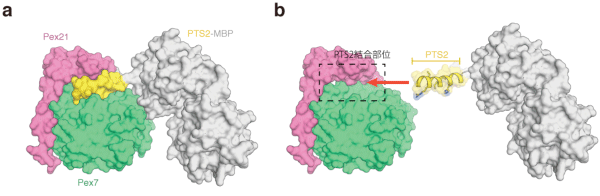
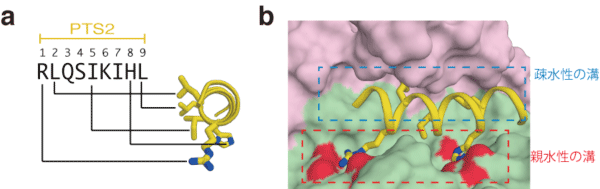
Pex7によるPTS2の認識機構を解明するために、潘研究員らはモデル動物としてペルオキシソーム研究が進んでいるパン酵母 Saccharomyces cerevisiae を用いました。パン酵母のペルオキシソーム酵素の一つであるチオラーゼは機能的なPTS2配列を持っています。その配列はPex7ともう一つの蛋白質(Pex21もしくはPex18)によって認識されることが知られていました。ヒトでも2つの蛋白質(Pex7とPex5)がPTS2の認識に必要です。潘研究員らは真核生物の蛋白質生産系であるメタノール資化性酵母 Pichia pastoris を用いて、パン酵母のPex7の大量生産系を開発しました。さらにPex21のPTS2認識に重要な領域を大腸菌で生産する系を構築し、PTS2、Pex7、Pex21の三者を混合して複合体を形成させ、結晶を作製しました。大型放射光施設(SPring-8)を利用してX線結晶構造解析を行い、1.8Å(オングストローム)の高分解能の結晶構造を決定することに成功しました(図1a)。この結果、PTS2の9アミノ酸の配列がPex7とPex21によって形成されたポケットに相補的に結合し、認識されるメカニズムが明らかとなりました(図1b)。
PTS2とPex7-Pex21複合体との結合はまさに「カギとカギ穴」の関係でした。PTS2はαへリックスの構造になることで、9アミノ酸の配列のうち1番目のアルギニン(R)と8番目のヒスチジン(H)の側鎖は同じ方向を向き、2番目のロイシン(L)、5番目のイソロイシン(I)、そして8番目のロイシン(L)の側鎖は同じ方向を向くことが判明しました(図2a)。これらのアミノ酸の側鎖はカギの凹凸を形成します。一方で、Pex7とPex21はカギ穴の部分凸凹を形成します。PTS2のアルギニンとヒスチジンの側鎖が納まる親水性の溝はPex7によって形成され、PTS2の2番、5番、8番目のロイシンやイソロイシンの側鎖が位置する疎水性の溝はPex7とPex21が上下から挟み込むようにして形作られます(図2b)。PTS2のアルギニンとヒスチジンは塩基性のアミノ酸でPex7上の溝にある酸性アミノ酸と静電的な相互作用をすることも判明しました。つまり、PTS2というのは凹凸の形だけで認識されるだけではなく、マグネットキーのように電気的な引き合う力や反発する力もその認識に関わっていました。
突然変異によりPex7の一つのアミノ酸が変化し、RCDP-1型を発症した患者の例が知られています。この変異の入ったアミノ酸はちょうどPTS2の側鎖を認識する溝のアミノ酸であることが分かりました。一方で、PTS2の認識に関わらないPex7のアミノ酸が突然変異しても、RCDP-1型になる可能性が低いと考えられます。今回私たちが決定した結晶構造に基づくことで、より正しい診断ができると考えられます。また突然変異によりPex7とPTS2の親和性が低下したことが原因となるRCDP-1型の患者に対して、PTS2との親和性を高めることができるような低分子、いわゆるケミカルシャペロンを開発する原子レベルの分子構造基盤を提供することができるようになりました。
《参考図》
a. Pex7とPex21とPTS2-MBPの結晶構造。PTS2とMBPはつながった1つの蛋白質分子です。3つの分子の表面を表します。b. 結晶構造から推定されるPTS2の結合様式。
a. PTS2の9アミノ酸の配列。アルファベットはアミノ酸の1文字表記、Rはアルギニン、Lはロイシン、Qはグルタミン、Sはセリン、Iはイソロイシン、Kはリジン、Hはヒスチジンを表します。PTS2のへリックスの中で、重要な5つのアミノ酸の側鎖を棒モデルで表示しました。b. PTS2の結合部位の拡大図。Pex7は緑、Pex21はピンクで色付けしました。PTS2のアルギニンとヒスチジンと静電的な相互作用する酸性アミノ酸の酸素原子を赤く色付けしました。
《用語解説》
*1 RCDP-1型
英語名はrhizomelic chondrodysplasia punctata type 1、日本語名は肢根型点状軟骨異形成症1型。PTS2を認識する蛋白質Pex7の機能異常が原因で、細胞機能に必須な酵素をペルオキシソームに輸送できなくなることで発症します。患者は体内のフィタン酸の増加やプラスマローゲンの減少などの症状を示します。症状が重篤な場合は生後数年以内に亡くなることが多いのですが、Pex7の機能異常の程度が軽い場合は数十年生きられる場合もあります。
|
《問い合わせ先》
京都大学大学院薬学研究科 構造生物薬学分野
京都大学渉外部広報・社会連携推進室
(SPring-8に関すること) |
- 現在の記事
- ペルオキシソーム病RCDP-1の分子機構の解明(プレスリリース)