トマトとウイルスの生き残り戦略を解明 -新たな抗ウイルス剤の開発に活用へ-(プレスリリース)
- 公開日
- 2014年08月20日
- BL38B1(構造生物学III)
2014年8月20日
独立行政法人農業生物資源研究所
国立大学法人大阪大学
学校法人岩手医科大学
ポイント
•トマトのウイルス抵抗性タンパク質が、ウイルスの増殖を抑える仕組みをタンパク質の立体構造から明らかにしました。
•トマトとウイルスが互いに幾つかのアミノ酸を変化させる生き残り戦略を有していることが分かりました(共進化とも言います)。
•現在、この成果を利用した抗ウイルス剤の開発に取り組んでいます。
予算:生研センター 新技術・新分野創出のための基礎研究推進事業 発表論文: |
研究の社会的背景と経緯
野菜のウイルス病のうち、モザイク病はその名のとおり葉にまだら模様ができ、収量を著しく低下させます(図1)。トマトモザイク病の病原であるトマトモザイクウイルス(ToMV)は剪定作業などの接触により簡単に広がるため、被害の拡大が大きな問題となっています。また、植物のウイルス病は治療方法が無いため、感染株は抜き取り除去する必要があります。ToMV抵抗性品種の育種手法として、野生種トマトがもつTm-1遺伝子を栽培種トマトに導入する方法が用いられてきました。しかし、Tm-1遺伝子をもつトマトにも感染できるToMV変異株が現れており、有効な防除法の開発が望まれています。これまでに、私たちは、Tm-1タンパク質がToMVのタンパク質と結合してToMVの増殖を阻止すること、ToMVは生き残り戦略としてTm-1と結合しないように進化して抵抗性トマトに感染することを明らかにしてきました。今回の研究では、Tm-1タンパク質とToMVタンパク質の複合体の立体構造を決定することなどにより、Tm-1によるToMV認識機構ならびにToMVによる抵抗性打破の機構の解明に取り組みました。
- Tm-1タンパク質はToMVの増殖に必要な複製タンパク質のヘリカーゼドメイン2)に結合することがわかりました。両者の結合は、生体に多く含まれる低分子化合物アデノシン三リン酸(ATP)3)が存在している場合にのみ確認できました。
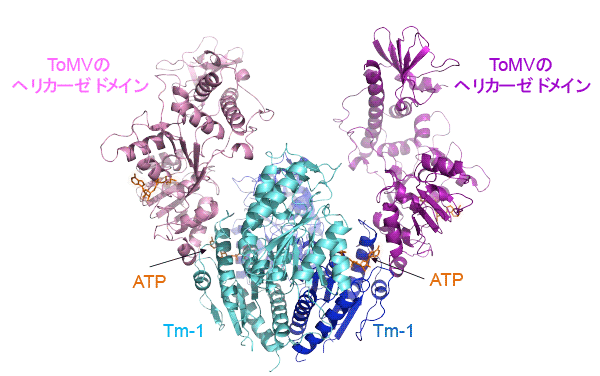
- X線結晶構造解析4)によりTm-1タンパク質とヘリカーゼドメインとの複合体構造を決定しました。Tm-1タンパク質とヘリカーゼドメインの間にはATP分子が接着剤のように存在し、複合体の形成に重要な役割を果たしていました(図2)。結晶構造の決定に用いたX線データの収集は、理化学研究所のSPring-8および高エネルギー加速器研究機構のPhoton Factoryで行いました。
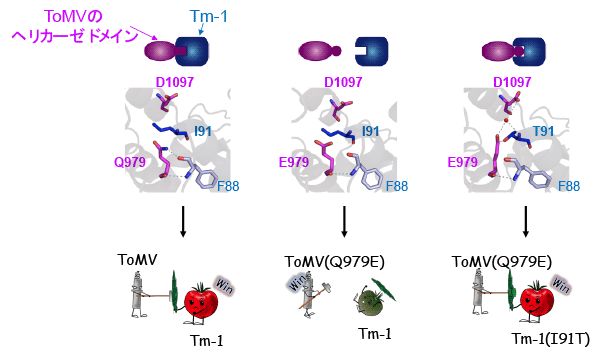
- タンパク質はアミノ酸が直鎖状に多数結合して構成されています。アミノ酸は20種類あり、どのようなアミノ酸がどのような場所に配置されているかが、タンパク質の機能発現にとても重要です。Tm-1タンパク質が結合できない変異型ToMVタンパク質は、ヘリカーゼドメインに2か所のアミノ酸変異をもつことが明らかになっています(変異株では、979番目のグルタミンがグルタミン酸に、984番目のヒスチジンがチロシンに変化しています)。これらのアミノ酸残基はTm-1タンパク質が結合する部位であったことから、ToMVはTm-1タンパク質との結合部位が変異することにより、Tm-1遺伝子による抵抗性を打破していることがわかりました。
- 野生種トマトの中には、変異したToMVの増殖も阻止する強力なTm-1遺伝子をもつ個体があります。この変異型Tm-1では91番目のイソロイシン残基がスレオニンに変化しており、ToMVの複製をより強く阻害することがわかっていました。私たちは、この変異型Tm-1(Tm-1(I91T))とヘリカーゼドメインとの複合体の構造決定にも成功しました。この構造から、Tm-1(I91T)の91番目のスレオニン残基が、水分子を介した水素結合ネットワーク5)を形成して複合体を安定化するため、Tm-1(I91T)タンパク質はTm-1タンパク質よりも強くヘリカーゼドメインと結合することがわかりました。
- 今回得られた結晶構造の情報を基にTm-1タンパク質とヘリカーゼドメインとの結合領域について詳細に解析しました。その結果、ToMVがどのようにTm-1タンパク質との結合を回避しているかが明らかになりました。これにより、認識と回避からなる植物とウイルスの攻防を分子レベルで示すことができました(図3)。
今後の予定・期待
Tm-1タンパク質の立体構造とその標的であるToMVヘリカーゼドメインの結合部位の立体構造が分かりました。また、ToMVヘリカーゼドメインが変化してTm-1タンパク質による認識を回避する仕組みも分かりました。今後、Tm-1タンパク質の代わりにこの部位に強く結合し、変異していくウイルスにも対応して増殖を阻止する新しい抗ウイルス薬剤の開発に取り組むこととしています。この開発により、ウイルス病を回避し安定した収量の確保が期待されます。
《参考図》
Tm-1タンパク質(水色と青色で表示)は2分子で安定な構造を形成しており、それぞれがToMVのヘリカーゼドメイン(ピンク色と紫色で表示)と1分子ずつ結合している。両者の接触面には両者を結合する糊のようにATPが存在している。
(左)Tm-1はToMVヘリカーゼに結合してウイルスの増殖を阻害する。このときTm-1の91番目のアミノ酸であるイソロイシン(I91)が、ToMVヘリカーゼの979番目のグルタミン(Q979)および1097番目のアスパラギン酸(D1097)と相互作用している。(中)ToMVは、Q979を変化させてグルタミン酸(E979)とすることで、Tm-1との結合を回避し感染する。(右)Tm-1はI91をスレオニン(T91)に変化させることにより、E979をもつウイルスの増殖を阻害する。
《用語解説》
1)トマトモザイクウイルス(ToMV)
トマトにまだら模様を生じ、収量を著しく低下させるモザイク病の病原ウイルスです。
2)ヘリカーゼドメイン
タンパク質の一部分がある機能を担っている場合、その部分をドメインとよびます。ToMVのゲノム複製を担うタンパク質は3つのドメインをもち、そのうちの1つがヘリカーゼドメインです。ヘリカーゼはDNAやRNAの高次構造をほぐす酵素のことです。
3)アデノシン三リン酸(ATP)
全ての生物がもつ低分子化合物で、生命活動に必要なエネルギーを与えるものですが、今回はタンパク質同士の結合を安定化させる役割を果たしていると推定されます。
4)X線結晶構造解析
タンパク質の立体構造を決定する方法の一つです。目的のタンパク質を結晶化し、その結晶にX線を照射して得られる画像を解析します。
5)水素結合ネットワーク
水素結合は分子内の水素原子を介した非共有結合です。水素結合がつながって形成されるのが水素結合ネットワークです。タンパク質内部やタンパク質間の相互作用面などに良く見られます。
|
《お問い合わせ先など》 研究推進責任者: 研究担当者: 広報担当者: (SPring-8に関すること) |
- 現在の記事
- トマトとウイルスの生き残り戦略を解明 -新たな抗ウイルス剤の開発に活用へ-(プレスリリース)