「運動や記憶を制御する受容体の巧みな分子内部運動の1分子観察に成功!」-アロステリック創薬に向けたX線計測技術の樹立- (プレスリリース)
- 公開日
- 2014年09月16日
- BL40XU(高フラックス)
2014年9月16日
国立大学法人 東京大学
独立行政法人 産業技術総合研究所
公立大学法人 兵庫県立大学
公益財団法人 高輝度光科学研究センター
発表のポイント
♦ 運動や記憶に関する情報伝達を司る重要な機能性タンパク質「ニコチン性アセチルコリン受容体」1分子の内部運動を世界で初めて動画として捉えた。
♦ 5つのタンパク質(サブユニット)から成るこの受容体は、各サブユニットが変化することによって受容体全体が多様に運動できることを証明した。
♦ 本受容体のサブユニットすべてが創薬の標的であり、その内部動態情報を取得できる本計測手法は、副作用のない創薬開発の基盤計測技術となる。
|
東京大学大学院新領域創成科学研究科の佐々木裕次教授を中心とする研究グループ(公益財団法人 高輝度光科学研究センターの関口博史博士、独立行政法人 産業技術総合研究所 創薬分子プロファイリング研究センター の久保泰副研究センター長、兵庫県立大学 大学院 生命理学研究科の宮澤淳夫教授、東京大学大学院新領域創成科学研究科の岡田真人教授ら)は、筋肉運動や記憶・学習を制御する極めて注目度の高いタンパク質「ニコチン性アセチルコリン受容体」1分子の3次元分子内部運動を、100マイクロ秒の時分解能で、かつピコメートル(原子直径の1/100の長さ)の精度で、動画として観察することに世界で初めて成功した。 (論文) |
発表内容
ニコチン性アセチルコリン受容体(nAChR)は、神経伝達物質・アセチルコリン(ACh)を受容することで分子構造の中心部分が開口し、それによって惹起されるイオンの流入によって細胞の興奮性を調節すると言われてきた。電気生理的測定によってnAChRはチャネルの閉、開、および脱感作状態(注5)を取ることは知られていたが、ゲーティング過程(注6)の各状態に移行する分子機構は全く分かっていなかった。本研究グループは、静的な構造情報に加え、各状態における1分子の内部動態情報が分子機構・解明に重要であると考え、DXTによる解析を試みた。
DXTは、数十nm(ナノメートル)程度の超微小金ナノ結晶を観察タンパク質分子に化学的に付加し、分子の内部運動に連動した標識ナノ結晶の動きをX線・ラウエ斑点(注7)の動きとしてマイクロ秒時分割追跡する1分子動画計測手法である。なお、この手法は、現在、世界最高精度で最高速度を誇る1分子動画計測手法である。今回、シビレエイの電気器官から取得したnAChRについて、ACh結合部位のαサブユニットを標的に金ナノ結晶で標識し、その動きを100マイクロ秒/frameの時間分解能で追跡した。その結果、AChの結合に伴ってねじれ運動と傾き運動の2つの回転軸の運動が活性化されること、またAChの受容体への結合を阻害する毒素が存在する条件下では、これらの運動が不活性化することが分かった。DXTにより得られた知見は、これまでのクライオ電子線結晶構造解析 (N.Unwin et.al., JMB 2012)による結果と矛盾しなかった。
本研究グループは、nAChRとその細胞外領域のアミノ酸構造が類似している(ホモログ)アセチルコリン結合タンパク質(AChBP)等の受容体タンパク質の構造解析結果を利用して、3次元運動計測するべき測定部位を決定した。また、nAChRのチューブ状結晶による先行解析で議論されているαサブユニットの回転運動が、DXT情報により再現できた。また、DXTからの情報では、時間軸(100マイクロ秒の高速1分子追跡 )情報が加わっているため、これまでの報告よりも定量的な動的解析ができ、理論計算との議論もより一層進めることが可能となった。加えて、先行研究では、決定できなかった脱感作状態 は、αサブユニットの異常な運動由来であることも突き止めた。これらの成果は、DXTデータ自動解析ソフトが完成し、多量データ解析が行え、それらの3次元多量データにベイズ推論(注8)を有効利用できたから成し得た。
また、この統計的な情報処理の向上は、DXTの最大の欠点であった「金ナノ結晶を標識しなければ、分子内部動態を計測できない」点を完全に克服できる可能性も示した。それは、金ナノ結晶のサイズによる分子内部運動との相関が極めて単純で (ナノ結晶が大きくなると計測される運動が鈍るという直線的関係)、その関係式を求めることで、金ナノ結晶を標識していない状態での真の分子内部運動の数値を推定することができる。例えば、AChが結合した場合は、無標識状態において、αサブユニットは1ミリ秒間に0.6度回転し、結合していない時は0.3度回転していた。この小さな分子内部運動で、ナトリウムイオンを始めとする陽イオンを細胞膜内に通すか通さないかを決定させていることが分かった。
さらに、副作用のない薬が創出可能となるアロステリック創薬の実現には、分子内部動態情報の取得が必須であることから、大きな期待が持たれており、特に、nAChRを構成する複数種類のサブユニットすべてが創薬の標的となっているので、今回の成果は非常に重要であると考えている。従って、DXTを用いてnAChRの内部運動計測に今回成功したことは、分子内部動態情報をDXTで簡単に測定できることを実践的に示した例となり、副作用のないアロステリック創薬に、極めて重要な基盤技術を提供するものと期待される。また、DXT自動解析ソフトの開発は今後も重要なDXT開発技術の1つであるといえる。
《用語解説》
注1 タンパク質のサブユニットとヘテロ構造とホモ構造
自然界に存在する多くのタンパク質や酵素は複数のタンパク質から成る多量体であり、その多量体を構成する各タンパク質をサブユニットと呼ぶ。多量体タンパク質の各サブユニットは、お互いに全く同一であったり、相同的であったり、全く異なる個々が全く異なる仕事を担ったりする。同一構造が多量体を形成している多量体分子構造をホモ構造と呼び、異なる分子から形成される多量体分子構造をヘテロ構造と呼ぶ。
注2 X線1分子追跡法 (Diffracted X-ray Tracking; DXT)
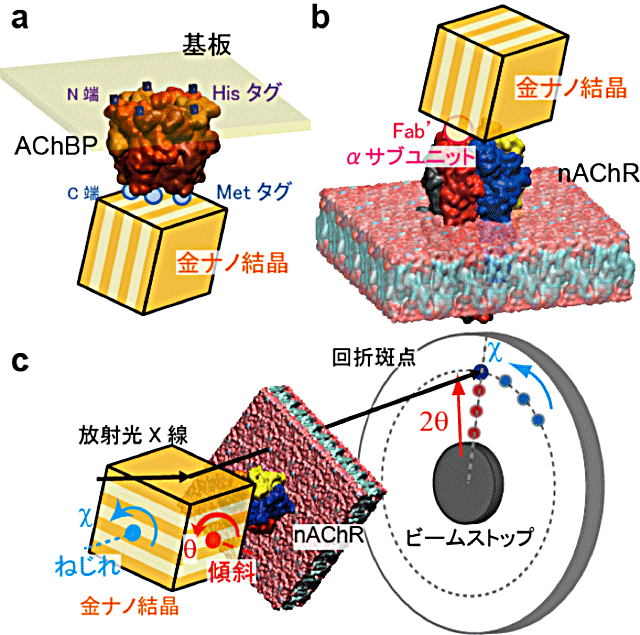
数十ナノメートル程度のナノ結晶をタンパク質に標識し、タンパク質の内部運動に連動したナノ結晶の動きを、ナノ結晶からのX線による回折ラウエ斑点の動きとして高速時分割追跡する手法。佐々木裕次教授が1997年に考案し、2000年に発表し、今までに多くのタンパク質の内部運動を計測し論文を発表してきてきた(Physical Review Letters, Physical Review, BBRC, Cell 等)。下図は、本研究で用いたnAChRの構造変化モデルにDXT法を適応した図(aはAChBPの場合, bはnAChRの場合, cはDXTの装置概略図)。本受容体の運動を示すために動画も添付した。
注3 分子内部動態
一般に分子内部動態とは、タンパク質分子において機能発現時に起こる分子運動の総称である。特に今回のイオンチャネル分子は、リガンドを結合して、その結合部位から離れた分子の中央部分が大きく変化することが知られていた。しかし、その情報は、動く前と動いた後の安定な構造情報を比較することで、その運動が存在すると類推していたにすぎなかった。分子内部動態(運動)自身がその機能と深く結びついていることから、時間軸でリアルな運動として見ることが今までの計測技術課題であった。加えて、分子運動はバラバラに動くので、その運動を正確に計測するには、1分子計測が必要で、世界で初めて成功した計測技術がDXT法である。
注4 アロステリック創薬
最近注目される創薬の総称。アロステリック薬は、受容体の活性部位とは別の場所に結合し、受容体の構造を変化させることで活性の度合いを微妙に調節することができる。アロステリック薬が期待される大きな理由は、副作用の回避だ。従来の薬は、受容体のサブタイプを見分けることなく取りついてしまうので、自然には起こらないような反応が生じ「副作用」となる。一方,アロステリック薬はサブタイプが異なると結合する場所がないので反応が起きない。この「効かない」作用を利用すれば、これまで安全な薬が作れなかった病気に対しても治療薬が見つかるかもしれない。「アロステリック」の語源である「アロステリー」という言葉は、ギリシア語で「別の」と「形」とを意味する合成語である。つまり、アロステリック効果とは、ある分子がある特定の部位に作用する場合、その場所ではない別の場所において、分子の形状の変化が現れる現象である。その変化は、分子内部運動の連携的な高速伝達現象が介している。しかし、今までその分子内部運動を高速に正確に計測するする手段が全く無かった。それをDXTが実現した。アロステリック効果はジャック・モノー(1965年度ノーベル生理学医学賞受賞者)、ワイマン、ジャン・ピエール・シャンジューらによって提案された。分子の協同性という意味もある。
注5 脱感作状態
チャネル受容体にリガンドが結合しているのにチャネルが開かない状態をさす。今まで、構造生物学において、チャネル受容体の構造決定を多くの研究者が試みたが、その本質でもある不安定性のために、静的な構造情報として得ることはできなかった。今回のDXT結果からも、その脱感作状態は、非常に特異的な動的状態をさすものであることが明確化された。今回の研究成果により、長年の夢が実現したと言える。
注6 ゲーティング過程
細胞の表面にあり、細胞内外を出入りするイオンの通り道となるチャネル分子において、イオン透過路開閉(ゲーティング)に伴う構造変化過程を示す。この過程を直接観察することは、今まで誰も成功していなかった。チャネル分子は、細胞を覆っている細胞膜という絶縁物の中に埋まっており、分子の中心部分に親水性イオン透過路(チャネルポア)を持つ。チャネル分子の本質的な機能は、このイオン透過機能とゲーティング過程であり、この両方の機能を1分子レベルで計測することが今までの計測技術課題であった。
注7 X線・ラウエ斑点
X線による回折現象の1つ。例えば、X線背面反射法を用いて単結晶体に白色X線を照射した時、ブラッグ角を満足するX線フィルム上の位置に周期的にラウエ斑点が現れる。単色X線を用いる場合は、ブラッグ反射と呼ぶ。今年2014年は、マックス・テオドール・フェリックス・フォン・ラウエがノーベル物理学賞を受賞して100年目に当たるので世界結晶年のお祝いが世界各地で行われている。
注8 ベイズ推論
すべての分子内部運動は、正規(ガウス)分布を持って運動する。しかし、ある場合は、それが数種類(数個)重なる場合があり、その数も未知数の場合が多々ある。この問題を解決するキーテクノロジーの一つがベイズ推論である。
|
《問い合わせ先》
(SPring-8に関すること) |
- 現在の記事
- 「運動や記憶を制御する受容体の巧みな分子内部運動の1分子観察に成功!」-アロステリック創薬に向けたX線計測技術の樹立- (プレスリリース)