低ノイズ・低粘着性・低コストのタンパク質結晶輸送媒体を発見 -生理条件に近いタンパク質の高分解能構造解析に期待-(プレスリリース)
- 公開日
- 2017年04月10日
- SACLA BL3
2017年4月10日
理化学研究所
京都大学
大阪大学
高輝度光科学研究センター
|
理化学研究所(理研)放射光科学総合研究センターSACLA利用技術開拓グループの菅原道泰特別研究員(研究当時)、岩田想グループディレクター(京都大学大学院医学研究科教授)、京都大学大学院農学研究科の桝田哲哉助教、大阪大学蛋白質研究所附属蛋白質解析先端研究センターの鈴木守准教授、高輝度光科学研究センターXFEL利用研究推進室の登野健介チームリーダーらの共同研究グループ※は、X線自由電子レーザー(XFEL)施設「SACLA[1]」のX線レーザーを用いた「連続フェムト秒結晶構造解析(SFX)[2]」(1フェムト秒は1,000兆分の1秒)において、タンパク質結晶輸送媒体として「ヒドロキシエチルセルロース[3]」を用いると、コストを抑えつつ、結晶を安定供給し、測定ノイズも低減できることを発見しました。 論文情報 注1)2014年11月11日プレスリリース「連続フェムト秒結晶構造解析のための結晶供給手法を開発」 |
背景
タンパク質の立体構造(結晶構造)を決定するには、タンパク質結晶にX線を照射したときに得られる回折イメージを解析する「X線結晶構造解析」が適しています。大型放射光施設「SPring-8[5]」の放射光[6]をX線結晶構造解析に用いる場合、実験中にタンパク質結晶に放射線損傷を与えることが大きな問題でした。
X線自由電子レーザー(XFEL:X-ray Free-Electron Laser)施設「SACLA」のX線レーザーは試料への照射時間が10フェムト秒(1フェムト秒は1,000兆分の1秒)以下という超短時間のため、タンパク質が壊れる前の微小結晶の回折イメージを検出できます。このX線レーザーの特性を利用した主なタンパク質の構造決定法として、「連続フェムト秒結晶構造解析(SFX)」が注目されています。SFXでは、インジェクター(噴出装置)から噴出させた液状試料(多数の微小なタンパク質結晶を含む液体試料)にX線レーザーを照射し、各結晶からの回折イメージを連続的に収集します(液体ジェット法)。SFXは常温で行うことができるため、従来の低温条件下(100K、-173℃)で行う回折実験とは異なり、生理条件(生体内)に近い構造を得ることができます。しかし、この方法には10~100mgという大量のタンパク質から得た結晶を必要とするという問題がありました。
共同研究グループは2014年、タンパク質結晶を高粘度物質のグリースに混ぜ、インジェクターからゆっくりと試料を押し出し、さまざまなタンパク質結晶のX線回折実験を行うことができる「グリースマトリックス法」を開発しました。グリースマトリックス法では、ゆっくりと試料を流すため、液体ジェット法の1/10~1/100に相当する1mg以下のタンパク質試料での構造決定が可能になりました。しかし、グリースとタンパク質結晶を混合した際に、いくつかの試料で結晶に亀裂が入ったり、結晶が溶けたりするといった問題がありました。また、グリースに由来して回折イメージ上に現れるノイズ(散乱バックグランドノイズ)も無視できません。そこで、グリースと比較し回折イメージ上のノイズが低いヒアルロン酸をSFXに導入しましたが、その高い粘着力ゆえにインジェクターに吸着してしまうなど、安定に結晶を流すことが難しく、また非常に高価であることも問題でした。
今回、共同研究グループは、この問題を解決するため新たな結晶輸送媒体を探索しました。
研究手法と成果
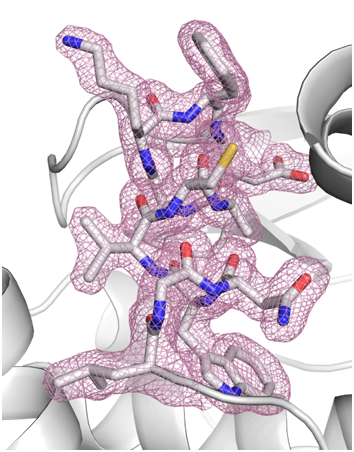
共同研究グループは結晶輸送媒体として、ヒアルロン酸とよく似た高粘度で水溶性のハイドロゲル[7]である「ヒドロキシエチルセルロース」を用いました。測定するタンパク質に選んだのは、結晶サイズ1マイクロメートル(μm、1μmは100万分の1メートル)および20~30μmのリゾチーム、2~4μmのソーマチンです。SACLA BL3で、ヒドロキシエチルセルロース水溶液に各タンパク質結晶を混ぜた試料を用いて、測定波長1.24もしくは0.95オングストローム(Å、1Åは100億分の1メートル)でSFXを行ったところ、それぞれ回折分解能[8]1.8、1.45、および1.55Åの回折データセットを収集できました。約1時間の測定時間で、構造解析に利用可能な30,000~40,000枚の回折イメージを収集でき、これらのタンパク質結晶構造の決定に成功しました。その1例として結晶サイズ1μmのリゾチームを用いて得られた結晶構造を図に示します。
結晶輸送媒体として、高粘度のヒドロキシエチルセルロースを用いて、結晶サイズ1μmのリゾチームから1.8Å分解能で結晶構造決定に成功した。図中のピンク色のメッシュは電子密度、メッシュ内スティックモデルの黄色は硫黄原子、青色は窒素原子、赤色は酸素原子、灰色は炭素原子を示す。
また、従来のグリースマトリックス法で結晶輸送媒体として使用していたグリースを不純物の少ないグリースに変更し、ヒドロキシエチルセルロース使用時とノイズを比較しました。このグリースは、従来のグリースに比べて、グリースに由来するノイズが低いという特徴がありますが、ヒドロキシエチルセルロースの方がより低ノイズであることを確認しました。さらに、ヒドロキシエチルセルロースを使用した場合、プロテイナーゼKに結合した金属からの弱いシグナルも検出することができ、そのシグナルを利用した構造決定にも成功しました。
以上の結果から、SACLAのX線レーザーを用いたSFXでは、結晶輸送媒体としてヒドロキシエチルセルロースを使うことで、結晶サイズ1μmでも結晶構造の決定に十分な精度の回折イメージを収集できることが実証されました。また、コストもヒアルロン酸に比べて約1,000分の1、不純物の少ないグリースに比べても約2分の1に抑えることができました。
今後の期待
現在、結晶輸送媒体としてヒドロキシエチルセルロース、グリースを用いて、さまざまなタンパク質のSFXを行っています。最近では、ヒドロキシエチルセルロースを用いたSFXで最高分解能1.20Åでの酵素の構造解析に成功しました注3)。またグリースを用いて、光合成の水分解反応において、光化学系Ⅱ複合体が酸素分子を発生させる直前の状態の立体構造を決定することに成功しました注4)。このタンパク質の場合、ヒドロキシエチルセルロースを用いると結晶に損傷を与えてしまいます。
今後、ヒドロキシエチルセルロース、グリースなどを相補的に利用することで、創薬ターゲットとなる膜タンパク質[9]を中心とした多様なタンパク質の高分解能での構造解析が期待できます。
注3)2017年3月31日プレスリリース「酵素の立体構造、「SACLA」のX線レーザーを用いて常温、原子分解能構造解析に成功」
注4)2017年2月21日プレスリリース「光化学系Ⅱ複合体が酸素分子を発生する直前の立体構造を解明」
<補足説明>
[1] SACLA
理研と高輝度光科学研究センター(JASRI)が共同で建設した日本初のX線自由電子レーザー(XFEL:X-ray Free-Electron Laser)施設。加速器の中で電子の固まりを正確な制御の下で一斉に振動させ、その電子の固まりからX線レーザーを発生させるX線発生装置。2006年度から5年間の計画で建設・整備を進めた国家基幹技術の一つ。2011年3月に完成し、SPring-8 Angstrom Compact free-electron LAser の頭文字を取ってSACLAと命名された。
[2] 連続フェムト秒結晶構造解析(SFX)
多数の微結晶を含む液体などをインジェクター(噴射装置)から噴出しながら、X線レーザーを照射し結晶の構造を解析する手法。配向の異なる多数の微小結晶からの回折イメージを連続的に収集する。SFXはSerial Femtosecond Crystallographyの略。
[3] ヒドロキシエチルセルロース
セルロースの一部をヒドロキシエチル基で置換することにより、水溶性としたもの。大量の水分を保持できる。
[4] 放射線損傷
X線の持つエネルギーによって、X線と相互作用した分子が壊れること。X線との相互作用で分子が壊れる場合だけでなく、分子が壊れる過程で生じる電子や、壊れた分子から生成する反応性の高い分子が観察対象の分子と化学反応する場合もある。一般的にタンパク質結晶の放射線損傷は、X線と水の相互作用をきっかけに、X線照射後ピコ秒(1ピコ秒は1兆分の1秒)の時間スケールで、水から生成する反応性の高い分子がタンパク質と化学反応することで起きる。
[5] SPring-8
兵庫県播磨科学公園都市にある世界最高の放射光を生み出す、理研の大型放射光施設。その運転管理と利用者支援は高輝度光科学研究センター(JASRI)が行っている。SPring-8の名前はSuper Photon ring-8 GeVに由来する。
[6] 放射光
相対論的な荷電粒子(電子や陽電子)が磁場で曲げられるとき、その進行方向に放射される電磁波。放射光は明るく、指向性が高く、また光の偏光特性を自由に変えられるなどの優れた特徴を持つ。
[7] ハイドロゲル
水によくなじむ物質によってナノサイズの3次元網目構造が形成されると、網目の中に閉じ込められた水分子は流動性を失い、系全体は固体状になる。このような物質をハイドロゲルと呼ぶ。身近な例として、寒天・ゼリー・豆腐・こんにゃくなどが挙げられる。
[8] 回折分解能
タンパク質を構成しているアミノ酸の平均的な直径は5Å程度である。そのため、多くの場合、2Åの回折分解能で取得したデータから得られる構造で、各アミノ酸側鎖の配向などを鮮明に見ることができる。
[9] 膜タンパク質
生体膜を構成しているタンパク質で、全ゲノムをコードするタンパク質の3分の1を占める。生体膜の表面にあるタンパク質と内部に埋もれたタンパク質がある。前者を膜表在性タンパク質、後者を膜内在性タンパク質と呼ぶ。外界からの刺激に反応する受容体、イオンポンプなどの輸送体など、環境からの刺激を強く受けるタンパク質であるため、創薬の重要なターゲットとされ、高効率な構造・機能解析法の創出が待たれている。
|
<発表者> ※研究内容については発表者にお問い合わせ下さい 京都大学大学院 農学研究科 大阪大学 蛋白質研究所附属蛋白質解析先端研究センター 高輝度光科学研究センター XFEL利用研究推進室 <機関窓口> 京都大学企画・情報部広報課国際広報室 大阪大学蛋白質研究所 庶務係 高輝度光科学研究センター 利用推進部 普及情報課 |
|
※共同研究グループ |
- 現在の記事
- 低ノイズ・低粘着性・低コストのタンパク質結晶輸送媒体を発見 -生理条件に近いタンパク質の高分解能構造解析に期待-(プレスリリース)
 spring8.or.jp(菅原)
spring8.or.jp(菅原)