初めて解像された膜蛋白質と燐脂質の相互作用のダイナミクス(プレスリリース)
- 公開日
- 2017年05月04日
- BL41XU(構造生物学I)
2017年5月4日
東京大学
高輝度光科学研究センター
発表のポイント:
◆新開発の結晶構造解析技術を用いて、生体膜を構成している燐脂質(注1;図1)と医学的にも極めて重要な膜蛋白質であるカルシウムポンプ(注2)の相互作用のダイナミクスが初めて可視化された。
◆膜蛋白質の機能発現に生体膜がどうかかわるか、その一般則が初めて明らかになった。
◆今後の創薬の標的の大部分を占める膜蛋白質の働きを理解する上でブレークスルーをもたらす画期的な研究である。
|
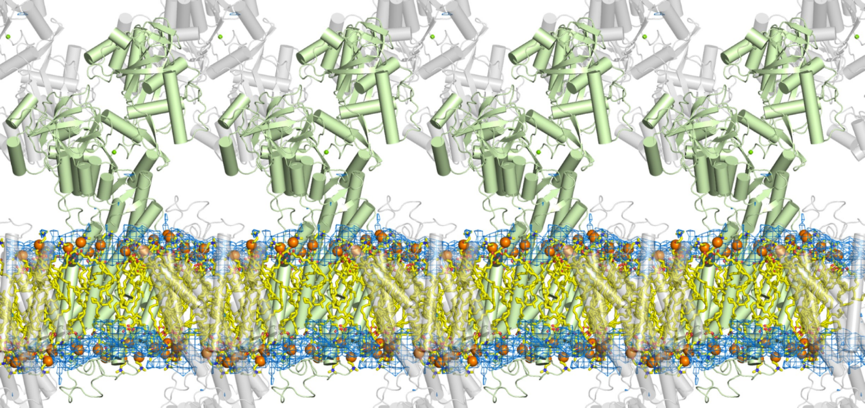
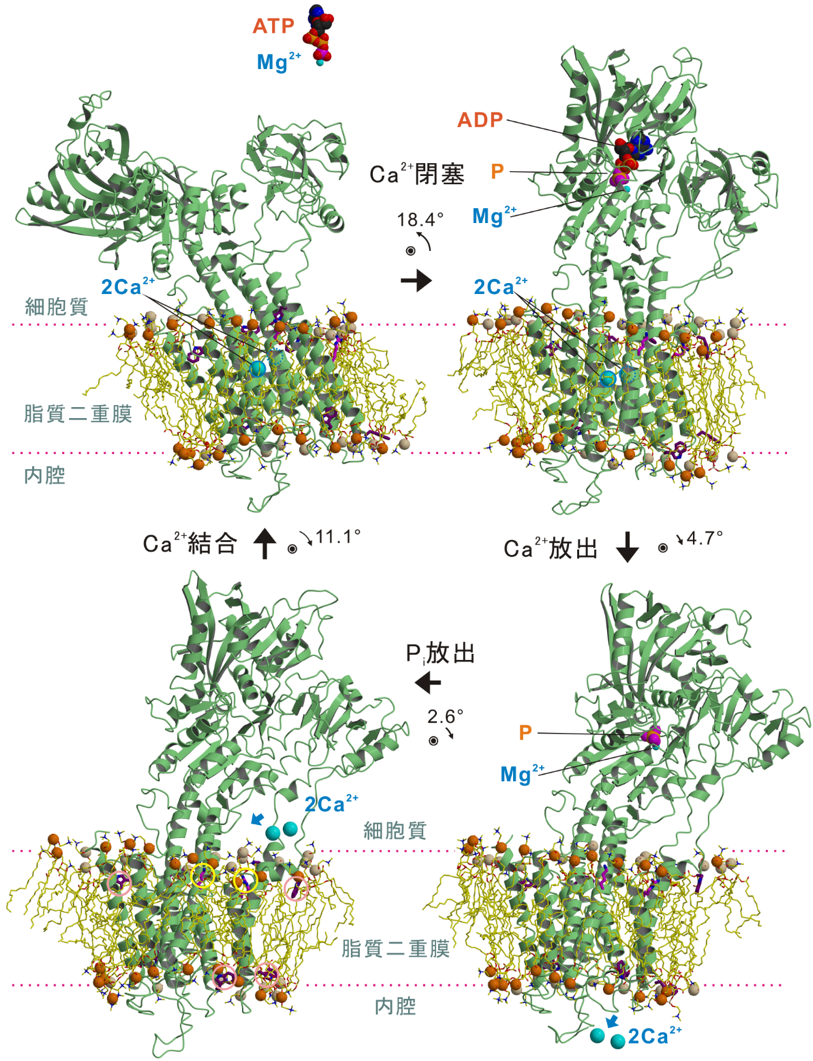
今回、東京大学の研究グループは、高輝度光科学研究センターの研究グループと共同で大型放射光施設SPring-8(注3)を用い、4つの異なる状態におけるカルシウムポンプ蛋白質結晶中の脂質二重膜を可視化した(図2, 3)。 発表雑誌: |
発表内容:
① 研究の背景・先行研究における問題点
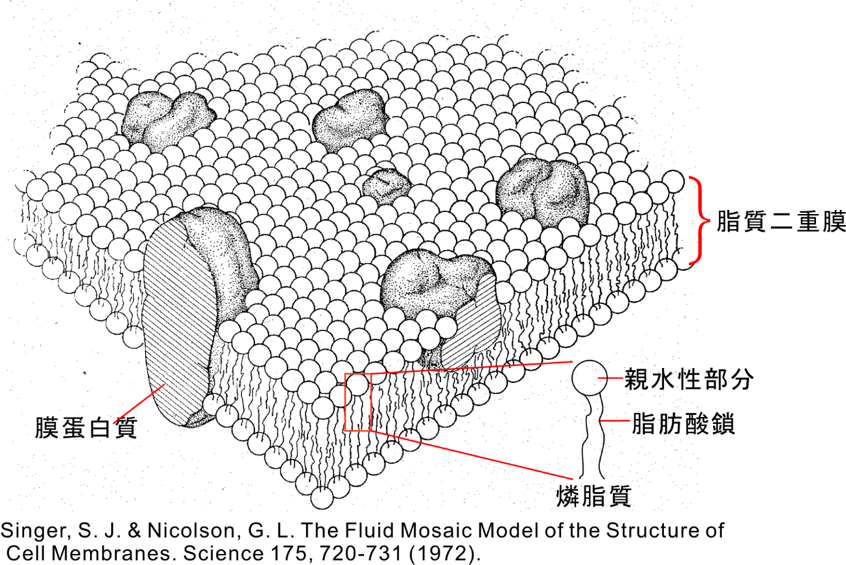
膜蛋白質は生体膜(脂質二重膜)に存在する蛋白質であり、豊島教授グループによる一連の構造生物学研究によって、イオンポンプ蛋白質は大規模な構造変化を起こすことも明らかになった。しかし、膜蛋白質を取り囲む生体膜(脂質二重膜)がその構造変化や機能発現にどうかかわっているかは、ほとんどわかっていなかった。すなわち、膜蛋白質が膜にたいしてどういう向きで、どういう位置で挿入されるのか、膜の厚さはどうやって決まっているのか、蛋白質の構造変化に対し燐脂質は追随して一緒に運動するのか、等の基礎的情報もなかった。1972年に発表された、SingerとNicolsonによる流動モザイクモデル(注4; 図1)から大きな進歩は見られていなかった。
その原因は、生体膜を構成する個々の燐脂質を解像できるレベルで生体膜を可視化する技術が存在しなかったためである。放射光施設の充実などX線結晶解析技術・設備の進歩によって膜蛋白質そのものの結晶構造解析は数多く行われるようになったが、通常の解析では、蛋白質間の間隙や蛋白質に存在する窪みに固定された脂質分子1,2個が解像されるにすぎない。これは、脂質分子の運動性が高いため、通常の結晶解析に使われる領域には構造情報が無いためである。
一方、豊島教授グループによるカルシウムポンプの反応中間体の構造研究から、脂質二重膜はポンプのメカニズムの一部として組み込まれており、脂質二重膜の硬さは反応サイクル中に変化する必要があると考えられたが、そんなことはあり得るのだろうか、というのが研究の動機であった。
しかし、上述のように解析技術が存在しないため、データ収集に特別の工夫が必要なだけでなく、解析ソフトウェアも独自のものを開発する必要があった。それが、本研究で開発された、「X線溶媒コントラスト変調法」とよばれるものである。装置とその制御ソフトウェアの開発は高エネルギー加速器研究機構・物質構造科学研究所 清水伸隆准教授(研究当時:高輝度光科学研究センター)・高輝度光科学研究センター タンパク質結晶解析推進室 長谷川和也チームリーダーが担当し、解析ソフトウェアは豊島教授の指導の下で東京大学分子細胞生物学研究所の乗松良行特任研究員が開発した。最初の予備的データ収集は2001年に行なわれ、研究には15年を要した。
本研究以前にわかっていたことをまとめてみると以下のとおりである。
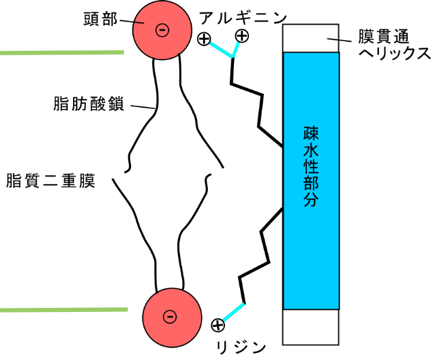
・膜の厚さは、リジン・アルギニンという塩基性(正の荷電を持つ)アミノ酸残基が膜の中(疎水性部分)から首を伸ばして(正確には長い側鎖を伸ばして)燐脂質の燐酸部分と強く結合するので、その位置で決定される(というか影響を受ける)。これをsnorkelingと言う(図4)。
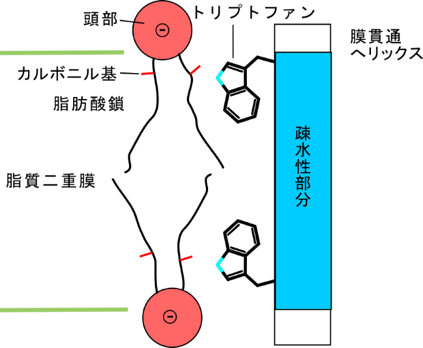
・塩基性ではないが、トリプトファンも膜厚に影響を与える。おそらく燐脂質のカルボニル基と水素結合をつくる(図5)。
・燐脂質との相互作用におけるリジン・アルギニンとトリプトファンの役割の違いはよくわからない。
② 研究内容
開発した「X線溶媒コントラスト変調法」を、医学的・生物学的に極めて重要な膜蛋白質であるカルシウムポンプの4つの状態の結晶に適用し、ポンプ蛋白質とそれを取り巻く個々の燐脂質をすべて(蛋白質一分子あたり約40個)解像することに成功し、燐脂質頭部の原子モデルを当てはめ精密化した。その結果、膜蛋白質と燐脂質の間には緊密でダイナミックな相互作用があることが示された。特に、ともに膜の厚さに影響を与えることがわかっていたリジン・アルギニンとトリプトファンとは明確に異なった役割を持ち(前者は「錨」であり後者は「浮き」)協働していることが明らかになった(図3参照)。
主な結果は以下のとおりである。
・膜の厚さは決して均一ではない。また、蛋白質を取り囲む燐脂質の数も変化する。従って、構造変化に伴って力が働くはずで、その力は構造変化の駆動力として使われる可能性がある。
・膜に対する蛋白質の向きを決めるのは主としてトリプトファンである。トリプトファンは溶媒と脂質の界面に存在する「浮き」の役割を持つ。燐脂質と結合する必要は無いので、膜貫通へリックスの大きな (~20 Å (注5))膜面に沿った動きに適している。
・膜貫通へリックスの運動に伴い、膜内から側鎖を伸ばしているリジン・アルギニンと結合している脂質(図4)は一緒に動く。特に、垂直な運動の時には追従し(局所的な歪を生み出す)、元に戻す力を生み出す。
・一方、膜外(細胞質側)から燐脂質と結合するアルギニンは相手となる燐脂質を変え、その燐脂質を特定の状態を安定化する「錨」として使っている。
・膜貫通へリックスの運動に伴って、へリックスの疎水性の部分が溶媒に露出しないように、また親水性部分が脂質二重膜の疎水性部分に露出しないように、蛋白質側はいろいろな変化をする。特に、膜貫通へリックスの大きな運動を許すために、分子全体の傾きが変化すること(図参照)は驚きであった。このときには、4つのトリプトファン残基が「浮き」となって、いつも膜面と平行になっていた。
このように、本研究によって、燐脂質と膜蛋白質の相互作用の詳細が初めて明らかになり、脂質二重膜は膜蛋白質の機能と密接に関わっていることがわかった。
③ 社会的意義・今後の予定
本研究で得られた膜蛋白質と生体膜の相互作用に関する詳細な情報は、今後ますます重要になるであろう、膜蛋白質の計算機によるシミュレーションに多大な影響を与える。また、他の膜蛋白質でも同等の情報を得ることができるよう、他の手法の開発も目指している。特に、中性子線回折への展開は学術的に重要である。
本研究は豊島教授を代表とする日本学術振興会科学研究費補助金 特別推進研究「薬剤開発を視野に入れた膜輸送体の構造研究」の一環として、また、大型放射光施設SPring-8の長期課題として実施された。データ収集にはSPring-8の共用ビームラインBL41XUが使用された。
緑色と灰色はカルシウムポンプ蛋白質。棒はへリックスを示す。 水色の網は今回の研究によって得られた、脂質二重膜の燐脂質頭部に対応する電子密度図。オレンジ色の球は燐脂質頭部に含まれる燐原子を示す。脂肪酸鎖の部分は計算機シミュレーションによる。脂質二重膜は、蛋白質のそばでは、決して平坦なものではないことに注意。
数値は次の状態へ移るときに生じるポンプ蛋白質全体の傾きの変化を、ピンクと黄色の円はそれぞれトリプトファンと塩基性アミノ酸(リジン・アルギニン)残基を示す。
アルギニンもリジンも長い側鎖を持っており、且つ正の荷電を持っている。膜貫通へリックスの疎水性部分から側鎖を伸ばして負の荷電を持つ燐脂質頭部と強く結合する。膜の疎水性部分から首を伸ばして結合する様がシュノーケルのようなので、snorkelingと呼ばれる。
これまでの研究からは図のような相互作用が考えられていた。本研究の結果、このような相互作用は主要なものでないことが判明した。
用語説明
注1: 燐脂質
燐酸基を含み親水的な頭部と疎水的な2本の脂肪酸鎖からなる(図1参照)。生体膜の主要構成成分。
注2: カルシウムポンプ
カルシウムイオンを濃度勾配に逆らって生体膜を越えて輸送する蛋白質。細胞の中と外ではナトリウムやカリウム、カルシウムなどのイオンの濃度は異なっており、その濃度の違いを生体は信号伝達や、エネルギー源として他の蛋白質を動かすために用いている。その濃度差を維持するのがイオンポンプであり、生体膜中に存在する膜蛋白質である。濃度勾配に逆らってイオンを輸送するため、ATP(アデノシン三燐酸)の化学エネルギーがエネルギー源として用いられる。
注3: 大型放射光施設SPring-8
兵庫県の播磨科学公園都市にある、世界最高性能の放射光を生み出す理化学研究所の施設。放射光とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げた時に発生する、細く強力な電磁波のこと。SPring-8ではこの放射光を用いて、ナノテクノロジー、バイオテクノロジーや産業利用まで幅広い研究を行っている。
注4: 流動モザイクモデル
燐脂質が集合してできた脂質二重膜内に蛋白質分子がモザイク状に埋め込まれており、蛋白質は膜内を自由に 動けるというモデル(図1参照)。
注5: Å (オングストローム)
原子や分子などの非常に小さな長さを表すのに用いられる長さの単位。1Å (オングストローム)は1千万分の1 mm、0.1 nm(ナノメートル)と同じ長さ。
注6: 東京大学分子細胞生物学研究所附属高難度蛋白質立体構造解析センター
2010年に設立されたセンター。創薬の重要なターゲットの大半が膜蛋白質であるにも関わらず、膜蛋白質の立体構造登録数は全登録数の0.5%以下 に過ぎないという現実をふまえ、薬剤のターゲットになるような膜蛋白質を積極的に取り上げ、その立体構造を決定することによって創薬へのブレークスルーを目指している。
|
問い合わせ先: (SPring-8 / SACLAに関すること) |
- 現在の記事
- 初めて解像された膜蛋白質と燐脂質の相互作用のダイナミクス(プレスリリース)
- ひとつ後
- 燃料電池触媒の性能低下原因を解明
 iam.u-tokyo.ac.jp
iam.u-tokyo.ac.jp