X線自由電子レーザー施設SACLAによる、哺乳動物が生きるためのエネルギーを獲得する仕組みの解明(プレスリリース)
- 公開日
- 2017年07月15日
- SACLA BL3
2017年7月15日
兵庫県立大学生命理学研究科
理化学研究所
高輝度光科学研究センター
|
兵庫県立大学大学院生命理学研究科月原冨武、吉川信也、島田敦広、理化学研究所放射光科学総合研究センター吾郷日出夫、久保稔、高輝度光科学研究センター馬場清喜、他23名は、X線自由電子レーザー施設SACLA(BL3)を利用して、哺乳動物のチトクロム酸化酵素(呼吸酵素)の反応に伴う構造変化を精密に決定し、この酵素が食物から生命活動のための(生きるための)エネルギーを無駄なく獲得する仕組みを解明した。 論文情報 |
本研究ではSACLAによりO2とほとんど同じ様式でCcOと反応する一酸化炭素(以下COと略記)とCcOとの反応に伴うCcOの立体構造の時間変化を追跡し、水素イオンがH-経路に取り込まれた後に、O2が活性中心に含まれている銅イオンに結合することによりH-経路を閉鎖することを明らかにした。このようにして、水素イオンの逆流が効率よく防止されるため、取り込みも促進される。このような発見はタンパク質の高速の立体構造変化を正確に追跡することのできるSACLAを利用することができてこそ可能であったと言える。
CcOのエネルギー集積効率が精妙に制御されて、組織や細胞の正常な活動(恒常性)が維持されていることが、最近の種々のCcO活性制御因子(タンパク質)の発見により強く示唆されるようになっている。したがって、本研究によるCcOのエネルギー集積(獲得)機構の解明は生命現象の理解を深めることに貢献するだけではなく、CcO活性制御因子による組織や細胞の活動の制御機構の解明、したがって疾病の機構の解明に大きく寄与する可能性がある。また、H-経路の構造と機能は動物にしか保存されていないことが本研究によりさらに確実になったので創薬のターゲットになる可能性もある。
本研究成果は世界主要科学雑誌の一つであるScience Advances最新号(2017年7月14日号)に発表される。
背景
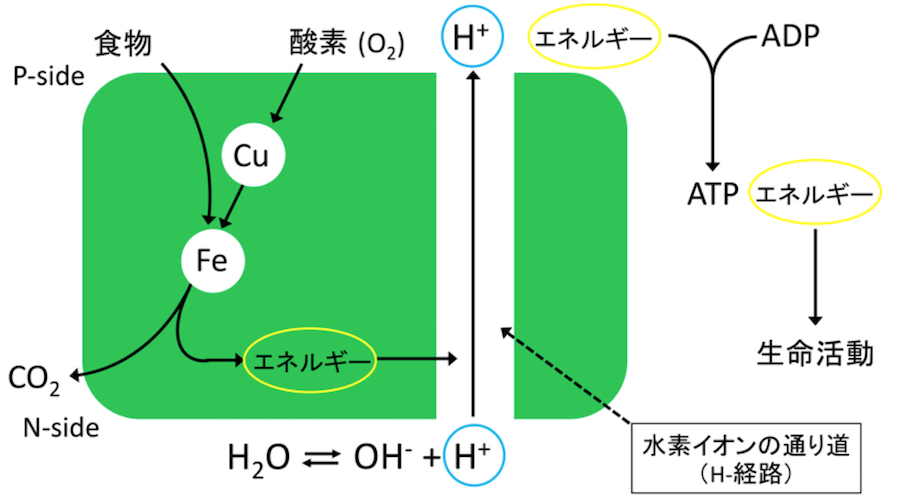
ヒトを含む哺乳動物はエネルギー源となる食物を酸素(O2)で完全に酸化して得られるエネルギーによりほとんどあらゆる生命活動のエネルギー源であるATPを合成している(酸素呼吸)。O2により食物を完全に酸化すること(例えば炭水化物の場合はCO2にまで酸化すること)ができるようになり食物から取り出し生命活動に利用できるエネルギーが飛躍的に増大したことが、現在の地球上での生物多様性をもたらした主要因であると考えられている。
この酸素呼吸の中心として機能するチトクロム酸化酵素は約90年前に発見されて以来、その機能の仕組みの解明は生命科学の最重要課題の一つであり続けている。しかし、この酵素の機能を化学反応として捉えようとする研究は1995年にX線結晶構造解析法によりCcOの立体構造が決定されてから本格的になったと言える。CcOはその酸素受容部位(FeイオンとCuイオンを含む)が取り込んだO2により食物を酸化し生じたエネルギーにより水素イオンをCcO(巨大なタンパク質)分子の一方から他方へ(それぞれN-side, P-sideと命名されている)H-経路と呼ばれる水素イオン輸送経路を経由して輸送される。その結果食物のエネルギーはP-sideに輸送された水素イオンに移送集積される。このようにしてエネルギーを集積された水素イオンによってATP合成酵素という別の巨大なタンパク質がATPを合成する(このP-sideへの水素イオン輸送までがCcOの役割である)。この水素イオン輸送過程において、N-sideへ水素イオンが逆流すると水素イオンのエネルギーは散逸しATP合成に利用不可能になる。したがって、精緻な水素イオン逆流防止機構をCcOは具備しているはずである。しかし、X線結晶構造解析法によりH-経路の立体構造が高分解能で決定されているにもかかわらずこの逆流防止機構はCcOの機能の仕組みの最大の未解明の問題の一つとして残されていた。その最大の原因は、従来のX線結晶構造解析は結晶中で静止しているタンパク質にしか適用できなかったことにある。CcOの水素イオン逆流防止機構はその反応中に機能しているため、反応中の立体構造の時間変化を追跡する必要があるがCcOのようにミリ秒の速さで進行する酵素反応に伴う酵素の立体構造変化を追跡することは全く不可能であった。
研究手法
CcOに限らず、タンパク質の機能解明のためにはその駆動する化学反応の進行に伴う立体構造変化を解析することが不可欠である。したがって、蛋白質の駆動する化学反応よりはるかに高速で立体構造を決定することが可能なX線自由電子レーザー施設SACLAは多くの生命科学研究者の夢の実現を期待させるものである。本研究ではSACLAを利用した立体構造の時間変化の解析(時分割X線構造解析)により水素イオン逆流防止機構の解明を試みた。上記防止機構はO2がCcOに取り込まれて食物のエネルギーを取り出す前に機能すると考えられるので、O2とCcOとの反応に伴う立体構造の時間変化を解析した。このときO2とほとんど同じ様式でCcOと反応することが知られているCOとの反応を解析した。また、結晶中でのCO結合反応を、新規に開発された超高感度時間分解赤外分光装置でも測定し、反応中間体分子種の増減を精密に追跡した。
成果
実験結果
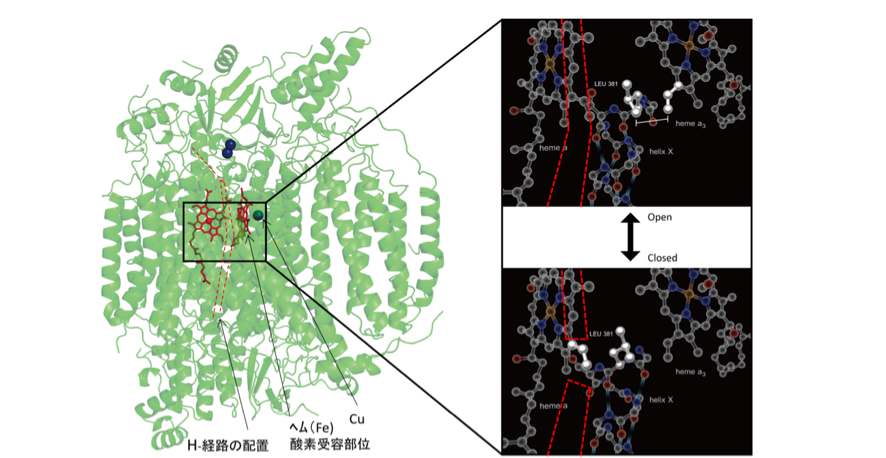
1)結晶中でも溶液中と同様にCOは酸素受容部位のFeイオンに最終的に結合する前にCuイオンに一時的に結合することが時分割X線構造および赤外分光解析により確かめられた。このCOのCuイオンへの滞留時間は約100ナノ(10-9)秒であるからこの中間体の立体構造はSACLAでしか決定することができない。
2)COがCuイオンに結合したとき(上述の中間体が形成された時)H-経路の立体構造変化により、N-sideの水分子のH-経路への可逆的侵入がその中間点付近で遮断された(図2参照)。これによりH-経路に輸送された水素イオンの水分子によるN-sideへの逆流は防止される(図2参照)(CO結合前の構造を”Open構造”、CO結合後の構造を”Closed構造”と命名する)。
3)COがFeイオンに移動してもH-経路の立体構造は変化せずClosed構造のままであった。
4)H-経路の開閉を制御する構造が検出された。時分割X線結晶構造解析による立体構造変化の解析によりCuイオンとH-経路を構成するアミノ酸側鎖の一つであるS382を連結する以下のリレーシステムによりH-経路の開閉は制御されていた。
[Cu---Fe---heme vinyl group---L381---S382]
heme vinyl groupとL381との20 pm (10-12 m)程度の微小な相対距離の変化によりこのリレーは機能していた。
ウシ心筋チトクロム酸化酵素のリボンモデル図に酸素受容部位とH-経路(赤破線)の配置を示す。H-経路の開閉を誘起する立体構造変化を拡大図として示す。
実験結果に基づく水素イオン逆流防止機構
本研究により以下のような機構が明らかになった。
i) 水素イオンがH-経路に取り込まれたことが酸素受容部位のCuイオンにより感知される。
ii) CuイオンのO2親和性が高まり、O2を取り込む。
iii) O2のCuイオンへの結合がトリガーとなり上述のリレーシステムが機能しH-経路はClosed構造をとる。
iv) O2がFeイオンへ移動し、食物分子を酸化しエネルギーを取り出す。
v) このエネルギーによりH-経路に輸送保管されている水素イオンをP-sideにまで輸送し、食物のエネルギーをP-sideの水素イオンに集積する。このときH-経路はClosed構造をとっているので水素イオンの逆流は防止される。
今後の期待
本研究ではO2と同様の様式でCcOに結合するCOとCcOとの反応の解析により水素イオン逆流防止機構を解明した(O2とCcOとの反応では、O2が結合した後のO2還元反応が重複するためO2のCcOへの結合反応経過を高精度で検出することが実験的に困難である)。しかし、COは食物分子を酸化することができないため、食物分子の酸化によって得られたエネルギーによって水素イオンをP-sideに輸送し、エネルギーを集積する機構の研究は不可能である。今後はO2とCcOとの反応のSACLAによる解析によりCcO本来の反応を原子の挙動として追跡し反応機構を解明することを計画している。上述の通り本酵素は酸素呼吸の中心酵素であるため、生命現象の理解を深めることに大きく貢献する。しかし、最近CcOの活性調節因子タンパク質が続々と発見されており、CcOは生命活動の恒常性の維持にも重要な役割をもつことが示唆されている。したがって本研究のようなCcOの反応機構の基礎的理解を深める研究成果は疾病の機構の解明にも役立つ可能性がある。また本研究をはじめとして水素イオン能動輸送機構の多様性(生物種によって機構したがってそれを駆動する構造が異なる)を強く示唆する研究成果が蓄積している。さらに上述の通りCcOは細胞エネルギー産生の根幹の酵素であるため、重要な創薬のターゲットになり得ることが示唆される。
本研究経費の一部はJST CREST Grant Number JPMJCR12M3から援助された。
【用語】
チトクロム酸化酵素…
チトクロムの一成分で、電子伝達系の末端で作用する酸化酵素。シアン化物や一酸化炭素などは、この作用を阻害する。
チトクロム…
生物の細胞内に存在するヘムたんぱく質。細胞呼吸において電子伝達体としての役目を果たす。
水素イオン(H+)…
水分子の解離(H2O = H+ + OH-)により生じる。細胞中は水で満たされているのでどこにでもある正イオン。
|
【研究に関する問い合わせ先】 兵庫県立大学生命理学研究科 【機関窓口】 公立大学法人兵庫県立大学播磨理学キャンパス (SPring-8 / SACLAに関すること) |
- 現在の記事
- X線自由電子レーザー施設SACLAによる、哺乳動物が生きるためのエネルギーを獲得する仕組みの解明(プレスリリース)
 spring8.or.jp
spring8.or.jp