温室効果・オゾン層破壊の原因である亜酸化窒素の生物的発生機構の解明(プレスリリース)
- 公開日
- 2021年05月18日
- SACLA BL3
2021年5月18日
兵庫県立大学
理化学研究所
広島市立大学
亜酸化窒素(N2O: Nitrous Oxide)は、二酸化炭素(CO2)の約310倍の効果を示す温室効果ガスであり、オゾン層を破壊する気体でもあります。地球環境のN2Oの75%以上は土壌中のカビや細菌などの微生物が産生します。しかし、そのN2O発生の分子機構は、20年以上未解明なままでした。 発表雑誌 |
背景
亜酸化窒素(N2O: Nitrous Oxide)は別名笑気(Laughing Gas)とも呼ばれ、麻酔にも使われる非常に安定な気体です。しかしその安定性ゆえに、発生すると地球の大気中に拡散し、太陽光に含まれる赤外線を吸収するので、温室効果ガスとなります。地球上のN2O発生量は、温室効果ガスとしてよく知られる二酸化炭素CO2の数千分の一程度ですが、その温室効果はCO2の約310倍であり、地球温暖化の観点から無視できません(文献1)。さらに厄介なことに、N2Oが地球の大気圏の外である成層圏にまで拡散すると、紫外線などにより窒素酸化物(NOx)に変化します。NOxは非常に反応性に富み、地球を取り囲むオゾン層を破壊します。1970年代にオゾン層破壊の原因物質としてフロンが注目され、その使用が規制されて以降、N2Oがオゾン層破壊の主要因となっています(文献2)。このように、N2Oは21世紀の地球環境保全を考える上で鍵となる気体の一つと指摘されてきました。
N2Oは、工場や車の排ガスや燃焼ガス、動物の糞尿などからも発生しますが、N2O発生の75%以上は農業が原因と言われています(文献3)。肥料として播く窒素化合物を、土壌中のカビや細菌などの微生物が分解する過程でN2Oが産生されるためです。このような生物的過程を「脱窒(Denitrification)」といいます。脱窒は土壌中など酸素の無い環境に生息する微生物の嫌気呼吸の一種で、硝酸イオン(NO3-)や亜硝酸イオン(NO2-)が逐次分解される過程です(NO3- → NO2- → NO → N2O → N2)。脱窒の中間生成物として産生されるN2Oが大気中に漏れ出ることになります。脱窒の各ステップは微生物が持つ金属酵素によって触媒されていますが、最終過程(N2O → N2)を触媒する金属酵素を持たない微生物もあり、その場合はN2Oが最終産物となります。
N2O発生、すなわち一酸化窒素(NO: Nitric Oxide)をN2Oに変換する過程は、鉄(Fe)を活性中心に含む酵素である一酸化窒素還元酵素(NOR: Nitric Oxide Reductase)によって触媒されます。この酵素反応は、2NO + 2H+ + 2e- → N2O + H2O です。NOは非常に反応性の高い気体であり、微生物の体内に留まると微生物自身が死滅してしまうので、脱窒の中間生成物として作られるNOを速やかにN2Oに変換し無毒化するNORは、脱窒を行う微生物にとって無くてはならない酵素です。
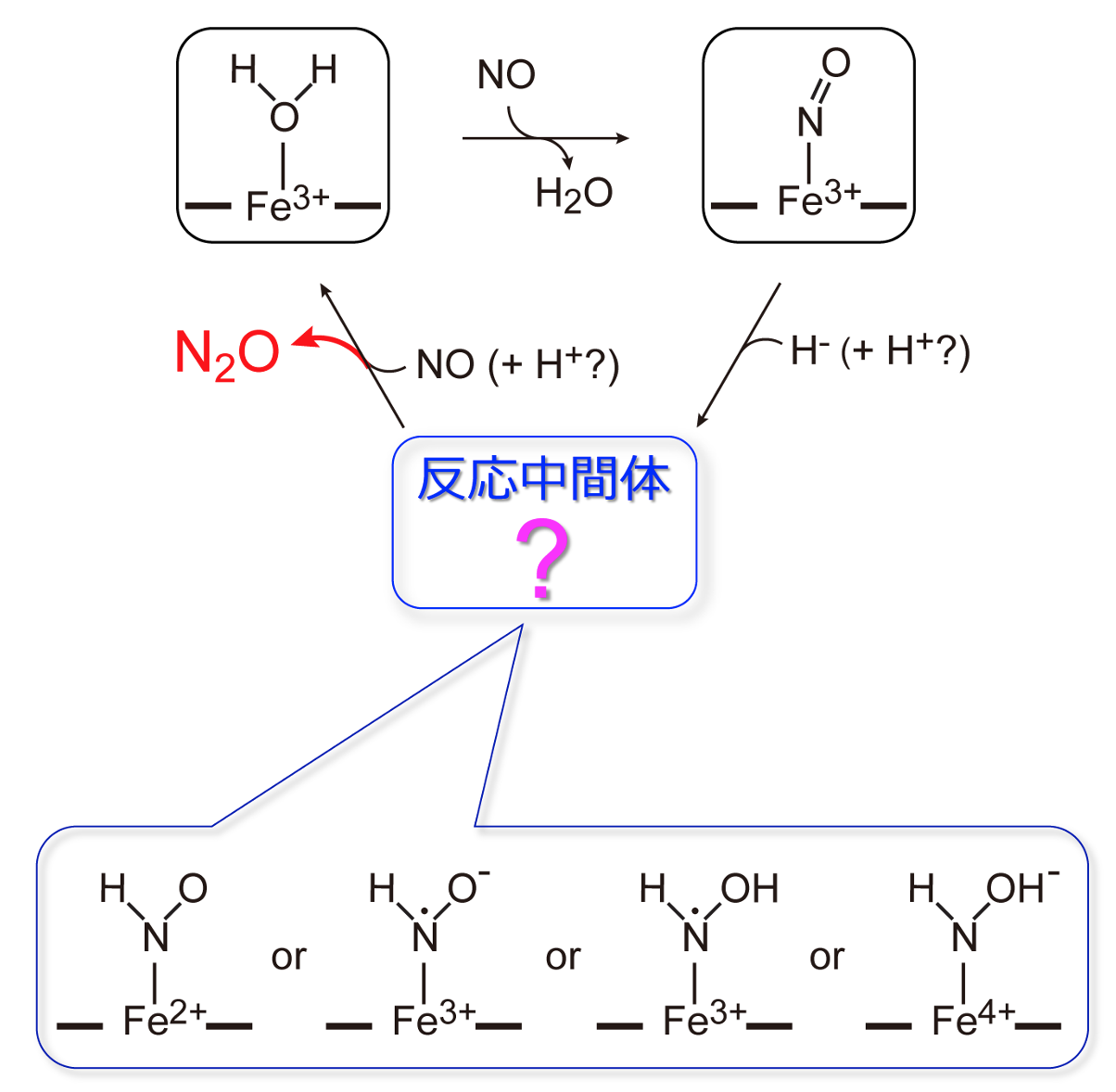
本研究で研究対象にした脱窒カビFusarium oxysporumのNORについては、約40年前に筑波大学の祥雲弘文助教授(現在、東京大学名誉教授)が発見し、25年前に本研究の主著者の一人である城教授が、当時の計測技術を駆使して、そのN2O産生機構のアウトラインを提案しました(図1)。この酵素反応中には数百ミリ秒という非常に短時間だけ反応中間体が現れます。N2Oが産生されるメカニズムを確定する上で非常に重要であるとの認識から、この25年間、この反応中間体の構造と電子状態は世界中で研究されてきました。これまでに4つの可能性が提案されていましたが(図1)、既存の測定技術では、その構造を確定できる決め手がありませんでした。
図1. 提案されていたN2O産生機構。
研究手法と成果
NORの反応中間体のように非常に短寿命な状態の構造・電子状態を決定するためには、実際に反応している最中の酵素を観測しなければなりませんでした。そのために共同研究グループは、紫外光を照射するとNOを放出するケージド化合物(注4)を反応開始剤として利用し、その直後に現れる反応中間体の構造解析にX線自由電子レーザーSACLAを光源とした無損傷X線結晶構造解析法を、電子状態の解析には時分割赤外分光法を用いました。
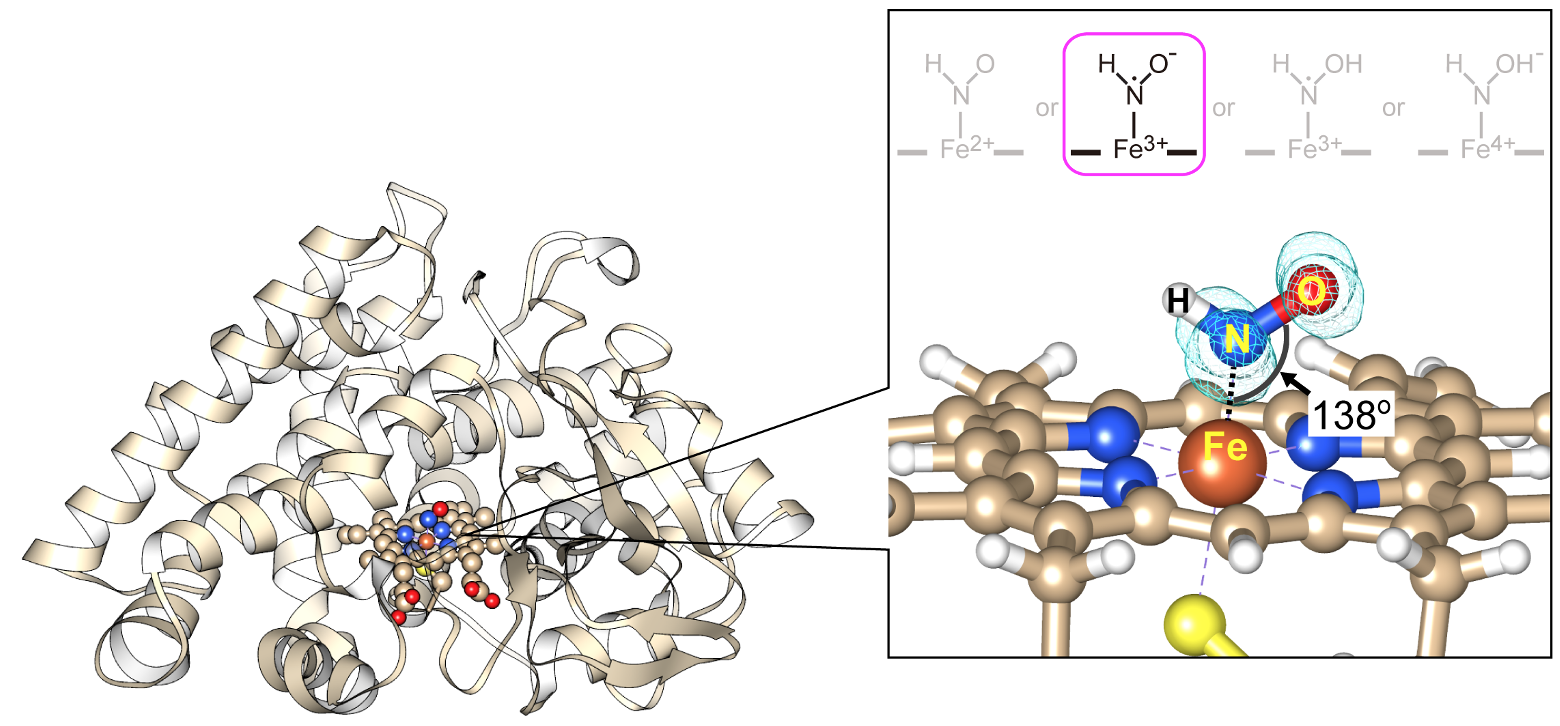
まず、酵素反応前のNORの結晶に紫外光を照射し、目的の反応中間体が現れた瞬間にそれを瞬時に凍結する装置を開発することで、NORの反応中間体を結晶状態で捉えることに成功しました。この反応中間体の結晶を用いて、SACLAの最先端技術、すなわち反応性の高い不安定な構造を無損傷で解析した結果、反応開始前は直線状だったNOの鉄(Fe)への配位構造(∠Fe-N-O = 158°)は、反応中間体では大きく折れ曲がった特殊な構造(∠Fe-N-O = 138°)へと変化していることが判明しました(図2)。
一方、短寿命の反応中間体の電子状態の測定は、従来の赤外分光装置では全く困難でした。そこで、これを可能とするために、共同研究グループは、フェムト秒赤外パルスレーザーを光源とする分光装置と、マイクロ流路デバイスを組み合わせることで、NORの酵素反応を連続的に追跡できる新しい時分割赤外分光装置を開発しました。この独自開発した装置によって、世界で初めてNOR反応の短寿命反応中間体の赤外分光スペクトルを得ることに成功しました。このスペクトルデータを詳細に解析し、前述の構造データと合わせて、さらに量子化学計算を併用することで、遂にNORの反応中間体の電子状態が、今まで提案されていた4つの状態の中の『Fe3+-NHO•-』であることを明らかにしました(図2)。この状態は非常に反応性に富む不対電子をもったラジカル状態(注5)であるため、もう1分子のNOと速やかに反応することができ、それによりN2Oが産生されるメカニズムを確定できました。この研究により、25年間未解決だった生物的N2O発生の分子機構の解明に終止符が打たれたことになります。
図2. NORの反応中間体の構造。H原子の位置は時分割赤外分光法と量子化学計算により決定。N原子とO原子上のメッシュは、反応性に富む不対電子の分布。
本成果の意義
冒頭で述べた通り、N2Oは今後の地球環境を考える上で非常に重要な気体です。本成果は、微生物によるN2Oの排出量を抑制する上で重要な分子基盤になると考えられます。また、本研究で開発した測定技術は、さまざまなケージド化合物と酵素の組み合わせに適用することが可能であり、高い機能をもつ生体触媒のしくみの理解など、今後の幅広い展開が期待されます。
本研究は、科研費助成事業の基盤研究(S)「一酸化窒素の生体内動態の分子科学」、新学術領域研究(研究領域提案型)「生命金属動態に関与するタンパク質分子の構造機能ダイナミクス研究」、「時間分解構造解析を補完する精密顕微分光計測」、学術変革領域(A)「大規模・高精度な第一原理計算による超秩序構造の機能解明とデザイン」、理化学研究所Pioneering Project「動的構造生物学」などの支援を受けて実施されました。
用語解説
(注1) SACLA
理化学研究所と高輝度光科学研究センターが開発し、兵庫県の西播磨地区に設置されているX線自由電子レーザー(XFEL:X-ray Free Electron Laser)の施設の名称。XFELは数フェムト秒(1フェムト秒は1,000兆分の1秒)の超短パルスで出力される超高輝度のX線のレーザーを示す。
(注2) 無損傷結晶構造解析
タンパク質が規則正しく並んだ結晶にX線を照射すると、X線の回折現象が起こる。回折されたX線の強度を計測して解析することで、タンパク質の構造を原子のレベルで可視化できるのがX線結晶構造解析である。通常のX線結晶構造解析法では、一つの結晶に1分以上X線を照射して回折データを測定するため、その間にタンパク質の構造の一部にX線が損傷を及ぼす場合があることが知られている。特に、金属を活性中心に含むタンパク質や不安定な反応中間体ではそのような損傷が顕著である。XFELの超短・超高輝度X線パルスを用いると、回折現象がフェムト秒で完結するため、X線による損傷が顕在化する前の構造を捉えることができる。X線パルスを照射するごとにタンパク質結晶を交換しながらデータ収集することによって、損傷のない(無損傷の)タンパク質の構造の決定が可能となる。
(注3) 時分割赤外分光法
分子は常に振動しており、その振動状態は分子内の電子分布(電子状態)を反映している。分子に赤外光を照射すると、その分子の振動状態のエネルギーに対応する特定の波長の赤外光が吸収される。すなわち、赤外分光法は、吸収される赤外光の波長から分子の振動状態を解析し、その分子の電子状態を明らかにする実験手法である。時分割赤外分光法は、酵素反応の中間状態など不安定で短時間だけしか存在しない分子の電子状態の情報を得る手法で、紫外光や可視光などの光照射によって系に刺激を与えて反応を開始させてから、任意の時間経過後に赤外光を照射し、その吸収波長を観測する実験手法である。
(注4) ケージド化合物
通常は安定だが、光を照射すると、極めて短時間で小分子を放出する化合物の総称。ケージドNOは紫外光照射後数マイクロ秒(1マイクロ秒は100万分の1秒)で一酸化窒素NOを放出する化合物である。他にも、ケージド電子、ケージドプロトン、ケージドアミノ酸、ケージドATPなど、生体反応に関連する多くのケージド化合物がある。
(注5) ラジカル状態
不対電子をもった状態。安定な分子では、2つの電子が“対”になっている。しかし、何らかの状況でその電子の対が保てなくなった分子、すなわち不対電子をもった状態の分子は、不安定で、反応性が高く(反応し易く)なっており、他の分子から1つ電子を奪って安定化しようとする性質をもつ。
参考文献
https://ourworldindata.org/greenhouse-gas-emissions;
https://www.nies.go.jp/whatsnew/20201005/20201005.html
(2) Science Vol. 326, 56-57 (2009); Science Vol. 326, 123-125 (2009).
(3) https://www.epa.gov/ghgemissions/overview-greenhouse-gases#nitrous-oxide
問い合わせ先 |
- 現在の記事
- 温室効果・オゾン層破壊の原因である亜酸化窒素の生物的発生機構の解明(プレスリリース)
 sci.u-hyogo.ac.jp
sci.u-hyogo.ac.jp