がんの多剤排出の原因となっているABCトランスポーターの立体構造をSACLAのX線自由電子レーザーを用いて決定(プレスリリース)
- 公開日
- 2021年12月23日
- SACLA
2021年12月23日
京都大学
理化学研究所
高輝度光科学研究センター(JASRI)
潘東青 京都大学大学院薬学研究科助教、中津亨 和歌山県立医科大学薬学部教授、加藤博章 京都大学大学院薬学研究科教授、中根崇智 大阪大学蛋白質研究所特任講師、岩田想 理化学研究所放射光科学研究センターグループディレクター、南後恵理子 理化学研究所放射光科学研究センターチームリーダー、登野健介 高輝度光科学研究センター主席研究員による合同研究チームは、SACLA1の非常に強力なX線自由電子レーザー(XFEL)を用いたシリアルフェムト秒構造解析(SFX)2により、様々ながんにおける多剤耐性の原因であり、医薬学研究において重要なABCトランスポーター3の立体構造を2.22Åの高分解能で決定することに成功しました。 論文タイトルと著者 |
背景
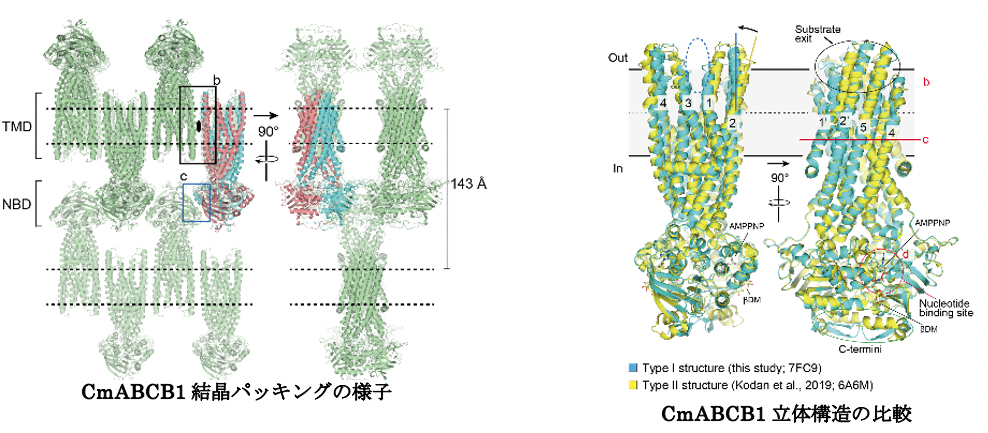
CmABCB1は、ABCトランスポーターとして知られるABCB1のホモログであり、構造を開閉させて薬物を細胞の内から外へ排出します。これまでにトランスポーター動作中の内向きと外向きの状態のスナップショットを明らかにしました。しかし、この開閉サイクルの連続的な動きを理解するための立体構造の情報はまだ不足しています。
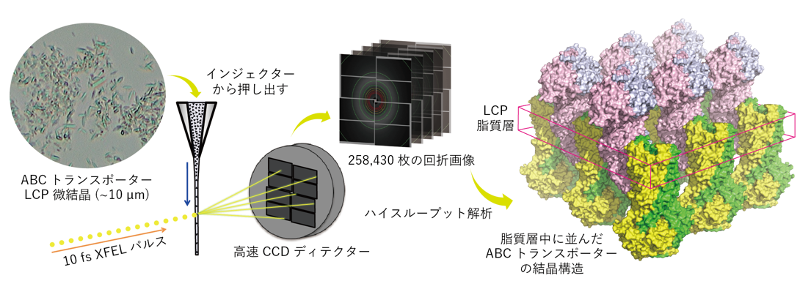
SACLAから放たれるX線は1パルスが数フェムト秒(フェムト秒=10-15秒)で、タンパク質が構造変化を起こす時間より非常に短いことから、結晶中でのタンパク質分子の動きを捉える手法として非常に優れています。そこで、これまでに得られていたCmABCB1の結晶を用いてSACLAで観察を行いましたが、構造解析に適した分解能は得られませんでした。そこで、本研究ではLCP法を用いて新たに結晶を作成し、2.22Å分解能での構造解析に成功しました。
研究手法・成果
本研究ではまず、LCP法での結晶化条件の探索を行いました。LCP法で用いるホスト脂質として、通常は9.9MAG(モノオレイン)が用いられます。ただし、脂質二重膜に埋もれている領域に対して可溶性領域が大きい膜タンパク質については、よりアシル鎖が短い7.7MAGなどが有効だとされています。CmABAB1は可溶性領域が大きいため、9.9MAGと7.7MAGを用いて結晶化条件の検討を行いました。その結果、7.7MAGとコレステロールの混合物をホスト脂質として用い、沈澱剤として1,4-ブタンジオール、添加剤として酢酸亜鉛を用いた際に、良好な微結晶が得られました。
SACLAから放たれるX線は非常に明るいため、結晶をすぐに損傷させてしまいます。そのため、1つの結晶に対して1枚のX線回折像しか撮影できません。そこで、溶液に懸濁させた結晶をインジェクターから流し出し、X線を順次照射していくシリアルフェムト秒結晶構造解析(SFX)という手法で測定を行いました。
LCP法で得られたCmABCB1結晶は、スポンジ相という比較的粘性が低い相において得られました。SFX法で測定する際、粘性が低いとゆっくりと流すことができないため、大量のサンプルが必要となります。そこで、結晶懸濁液の粘性を上げるために23種類の増粘剤を試したところ、Hydroxyethyl-cellulose (HEC)もしくはHydroxypropyl methylcellulose (HPMC)が適していました。最終的には、17.5% HPMCを加えて測定した際、2.22Å分解能という高分解能で外向き型の結晶構造を得ました。
得られたCmABCB1結晶中の分子の並び方を観察すると、本来は脂質二重膜中に位置する膜貫通領域(TMD)5と可溶性部分のヌクレオチド結合領域(NBD)6を使って密に並び、結晶中で綺麗なパッキングができていました。これが高分解能を実現できた要因であることが分かりました。また、すでに解析されている外向き型の立体構造と重ねて比較したところ、基質の出口となる細胞外側の領域の構造が変化しており、排出するときに逆流を防ぎながら基質を押し出すために柔軟な構造をしていることが示されました。
波及効果、今後の予定
今回の成果は、XFELを用いた時分割解析研究の扉が開かれたことを示すものです。ABCトランスポーターは開閉運動することで異物を排出します。CmABCB1は同一分子を用いて外向き型と内向き型の両方の立体構造を高分解能で解析できていますが、その途中の細かな動きは捉えられていませんでした。今後はcaged-ATPなど光解離性のリガンドを用いて反応を開始させることで、反応の詳細を明らかにすることが期待できます。研究が進み、分子認識と、排出の詳細な機構が明らかになれば、特定の異物のみを排出するようなABCトランスポーターの開発へ進んでいくものと思われます。
研究プロジェクトについて
本研究は文部科学省 X線自由電子レーザー重点戦略研究課題「創薬ターゲット蛋白質の迅速構造解析法の開発」、科学研究費助成事業挑戦的萌芽研究「創薬ターゲットの構造解析実現を目指したXFEL光による新規構造決定法の開発」などの支援を受け実施されました。
研究メンバーについて
京都大学大学院薬学研究科 潘東青助教、大山諒大学院生(研究当時)、中津亨准教授(現和歌山県立医科大学薬学部教授)、加藤博章教授、東京大学大学院理学系研究科 中根崇智特任助教(現大阪大学蛋白質研究所特任講師)、理化学研究所放射光科学研究センターSACLA利用技術開拓グループ 岩田想グループディレクター(京都大学大学院医学研究科教授)、南後恵理子 チームリーダー(東北大学多元物質科学研究所教授)、高輝度光科学研究センターXFEL利用研究推進室 先端光源利用研究グループ登野健介主席研究員等による合同研究チームにより行われました。
用語説明
1. SACLA:
理化学研究所と高輝度光科学研究センター(JASRI)による日本初のX線自由電子レーザー(XFEL:X-ray Free Electron Laser)施設。加速器の中で電子のかたまりを正確な制御の下で一斉に振動させ、0.1ナノメートル以下という世界最短波長クラスのX線レーザーを発振します。 2011 年 3 月 に完成し、SPring-8 Angstrom Compact free electron LAser の頭文字を取って SACLA と命名されました。
2. シリアルフェムト秒結晶構造解析(SFX:Serial Femtosecond Crystallography):
SACLAから放たれるX線自由電子レーザーパルスは非常に強力であるため、1回のX線照射で結晶は大きなダメージを受けてしまいます。しかし、フェムト秒という非常に短時間のパルス照射を行うことで、結晶が壊れる前に回折データを測定することができます。そこで、多数の微結晶を懸濁した溶液を調製し、インジェクターから溶液を噴出させて、X線レーザーの照射位置に結晶を連続的に通過させてフェムト秒パルスを照射します。SACLAから1秒間に30回放出されたX線パルスが様々な向きの多数の微小結晶に連続的に当たり、その結果得られた多数のX線回折像を解析して、結晶構造を決定するための手法がSFX法です。
3. ABCトランスポーター:
ATP Binding CassetteというATPによって駆動される部位を共通にもっている一群のタンパク質分子。ヒトでは48種類が知られており、そのほとんどが病気と関連しています。ABCBファミリーに属するP糖タンパク質(ABCB1)は最も有名で、多剤排出トランスポーターとして作用し、再発したがんが多剤耐性を獲得する原因分子として知られています。
4. ホモログ:
2つ以上の生物種で、類似したアミノ酸配列を持ち、共通した生理機能を果たすタンパク質やそのタンパク質をコードする遺伝子のことで、進化上、共通祖先由来であると考えられるもの。
5. 膜貫通領域(TMD:trans-membrane domain):
膜内在性タンパク質の膜中に埋め込まれた領域のこと。ABCトランスポーターの多くは、この領域が化合物輸送のポンプとなっています。
6. ヌクレオチド結合領域(NBD:nucleotide binding domain) :
ABCトランスポーターに共通するATPを燃料とするエンジンのこと。2つの塊でできており、その中央部にATPを結合して分解する装置を持っています。そして、ATPとの結合、ATPをADPとリン酸に分解、生成したADPからの解離の3つのステップを1サイクルとして、2つの塊が結合と解離を繰り返し、動力を発生します。これがTMDに伝わりポンプが駆動されます。
お問い合わせ先 |
- 現在の記事
- がんの多剤排出の原因となっているABCトランスポーターの立体構造をSACLAのX線自由電子レーザーを用いて決定(プレスリリース)
 pharm.kyoto-u.ac.jp
pharm.kyoto-u.ac.jp