高輝度放射光により神経伝達物質の輸送障害の分子メカニズムを解明(プレスリリース)
- 公開日
- 2022年02月10日
- BL41XU(構造生物学I)
2022年2月8日
東京大学
ポイント
◆シャルコー・マリー・トゥース病2型(CMT2)の患者で分子モーターKIF1A(注1)の遺伝子変異を発見し、この変異が神経軸索での細胞内輸送を障害することを明らかにしました。
◆変異型KIF1Aには、分子の動きが抑制されるようなアミノ酸の電荷異常があり、それによって軸索での細胞内輸送が遅くなることを見出しました。
◆今回の成果によって神経変性疾患の発症メカニズムの一端が明らかになり、分子標的治療や創薬に繋がることが期待されます。
東京大学大学院医学系研究科の研究グループは、分子モーターKIF1Aの変異体による軸索輸送の障害が、神経変性疾患の発症に関係することを明らかにしました。 発表雑誌: |
内容:
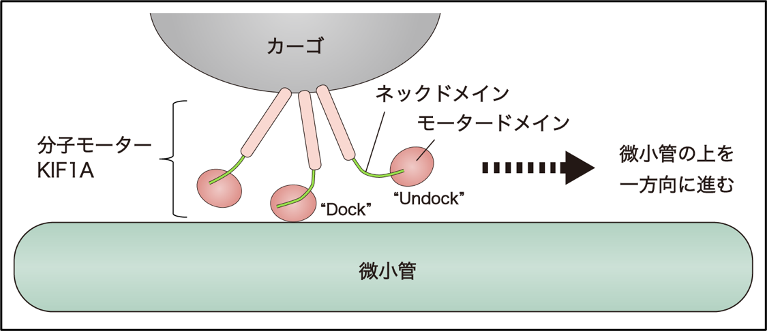
神経細胞は時に1mにもなる長い突起を持つ細胞で、細胞の働きの基となるタンパク質は、細胞内小器官やタンパク質複合体などとして長い突起の中を輸送されています。この輸送を担うのがKIF1Aです。KIF1Aは「積み荷(カーゴ)」となる細胞内小器官やタンパク質複合体と結合し、ATPの加水分解エネルギー(注2)を利用しながら、神経細胞内の「線路」である微小管に沿って進みます(図1)。KIF1Aの分子には、動力の発揮に必要なモータードメインと、モータードメインから続くネックドメインというヒモ状構造があり、これらのドメインがATPの加水分解反応に伴い構造変化を繰り返すことで、微小管の上を一歩一歩進みます。
シャルコー・マリー・トゥース病(CMT)は、筋萎縮と感覚障害が下肢から上肢にかけて進行する末梢神経性の神経変性疾患です。有病率は1/2500 人で、世界中に約260万人もの患者がいるとされています。CMT の原因遺伝子は80種類以上も特定されていますが、その発症メカニズムの全貌は未だ解明されておらず、CMT特異的に効果のある治療法は開発されていません。
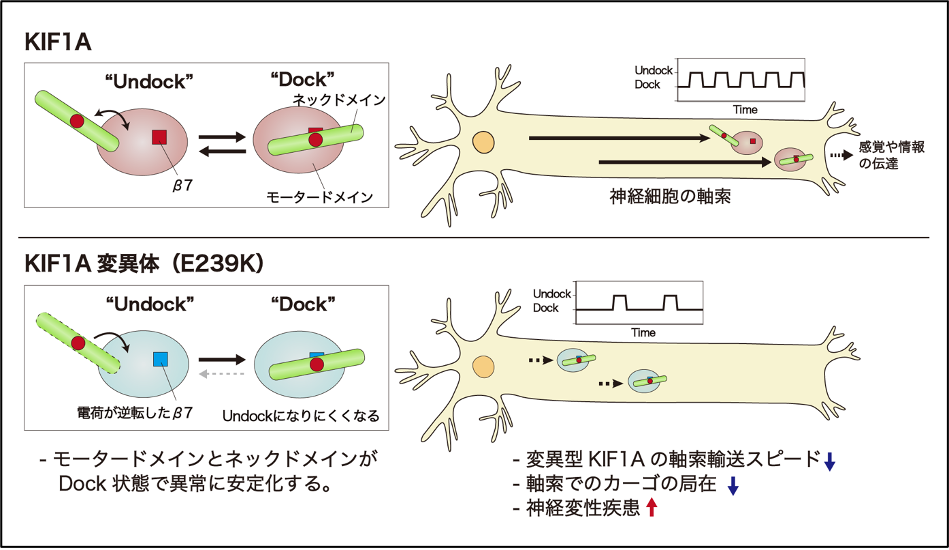
今回、米国の研究協力者とともに、シャルコー・マリー・トゥース病2型(CMT2)を発症する家系においてKIF1AのモータードメインにE239Kという変異があることを突き止めました。この変異型KIF1Aの特性を調べたところ、変異型KIF1Aの軸索輸送スピードは、野生型に比べて20%ほど低下していることが、①マウス神経細胞に発現させた蛍光標識付きのKIF1Aの動きの測定、②カーゴ(TrkA, Rab3A, synaptotagmin)の動きの測定、③精製し細胞外に取り出したKIF1AのATP加水分解速度の測定、④ガラス面に吸着させたKIF1Aの上を滑走する微小管の速度の測定により明らかになりました。また、変異型KIF1Aによる軸索輸送の遅延によって、カーゴの軸索での局在が損なわれることもわかりました。
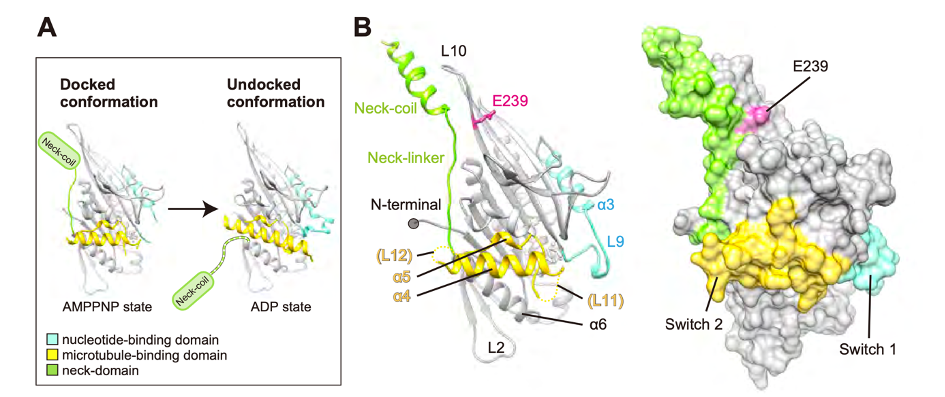
そこで、変異型KIF1Aによる輸送速度の低下の原因を探るため、X線結晶構造解析により変異型KIF1Aと野生型KIF1Aの分子構造を比較しました。すると、変異型KIF1Aではモータードメインの中のβ7という領域に過剰な正電荷が生じており、ネックドメインの負電荷と引き合っていることが示唆されました。これまでβ7領域の役割はよくわかっていませんでしたが、今回得られた分子構造から、β7領域はモータードメインとネックドメインの相互作用を調節する重要な領域であることが明らかになりました(図2)。さらに、定量的質量分析によって分子内の相互作用を測定する実験を行ったところ、変異型KIF1AではATP加水分解反応の後期に、モータードメインとネックドメインとの引き合う力が異常に強くなり、分子の構造変化が妨げられていることがわかりました。この結果、KIF1Aの輸送スピードが落ち、カーゴの輸送が障害され、CMT2を発症すると考えられます(図3)。
同じKIF1A変異がCMT2の患者だけでなく、痙性対麻痺や遺伝性感覚性自律神経障害の患者でも見つかっていることから、今回の成果は、神経変性疾患の原因のひとつを明らかにするとともに、神経変性疾患に対する分子標的治療・創薬に繋がることが期待されます。
本研究成果は、2021年2月8日(米国東部標準時)に科学誌「The EMBO Journal」に掲載されました。
本研究のX線結晶構造解析はSPring-8の共同利用課題(JASRI課題No. 2017A2539、2018A2552)および創薬等先端技術支援基盤プラットフォーム(略称:BINDS)(JP20am0101070)の支援課題(No. 1487)に基づき、SPring8-BL41XUを利用して実施されました。
図1 神経細胞内での分子モーターKIF1Aによる荷物の輸送。
図2 KIF1AはNeck-coilドメインがDock, Undockする構造変化によりモーターとしての動きを生み出す(A)。変異によりNeck-coilドメインが引きつけられ、UndockになりにくくなっていることがX線結晶構造から示唆された(B)。
図3 Dock, Undockの構造変化を繰り返すことでKIF1Aは細胞内でカーゴを運ぶ。変異体ではUndockになりにくく、軸索輸送スピードが低下する。
用語解説:
(注1)分子モーターKIF1A
神経系に多く発現するキネシンスーパーファミリータンパク質の一種。45種類あるキネシンスーパーファミリータンパク質は、細胞内でさまざまな物質と結合し、動くことで、細胞のさまざまな場所に必要な物質を運ぶ。記憶・学習などの脳の高次機能、体の左右軸の決定、腫瘍形成の抑制などの生命現象に関与する。KIF1Aは神経伝達物質を含むシナプス小胞前駆体を輸送する。KIF1Aは神経細胞の生存に必須であり、KIF1Aを全く持たないマウスは重篤な神経障害により生後すぐに死亡してしまう。
(注2)ATPの加水分解エネルギー
アデノシン三リン酸(ATP)が水分子と反応してアデノシン二リン酸(ADP)とリン酸とに分解する時に放出するエネルギー。このエネルギーを動力として用いることで、KIF1Aなどの分子モーターは微小管に沿って前進する。
お問合わせ先: |
- 現在の記事
- 高輝度放射光により神経伝達物質の輸送障害の分子メカニズムを解明(プレスリリース)
 m.u-tokyo.ac.jp
m.u-tokyo.ac.jp