病原菌はヘムを解毒して血中で増殖する -敗血症や髄膜炎の薬剤開発に貢献する膜タンパク質の解析-(プレスリリース)
- 公開日
- 2022年06月28日
- BL26B1(理研 構造ゲノムI)
- BL26B2(理研 構造ゲノムII)
- BL32XU(理研 ターゲットタンパク)
- BL41XU(生体高分子結晶解析 I)
2022年6月28日
理化学研究所
兵庫県立大学
理化学研究所(理研)生命機能科学研究センタータンパク質機能・構造研究チームの中村寛夫特別嘱託研究員、久野玉雄専任研究員、白水美香子チームリーダー、兵庫県立大学大学院理学研究科の城宜嗣特命教授、マフーズ・ラーマン大学院生らの共同研究グループは、病原菌(グラム陽性細菌[1])にとって有毒となる宿主由来のヘム[2]を排出する膜タンパク質「ABCトランスポーター[3]」の仕組みを解明しました。 論文情報 |
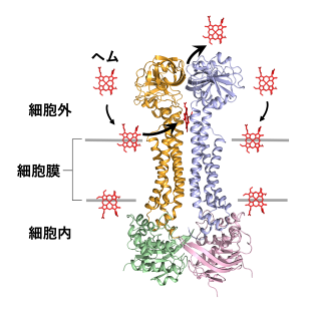
病原菌の細胞膜に侵入したヘムを捉えて排出するABCトランスポーターHrtBAタンパク質の構造
背景
鉄はほとんどの生物にとって必須の元素です。生物内の鉄の多くは、鉄イオンが環状の有機分子(ポルフィリン)に覆われたヘム(鉄プロトポルフィリンIX)として存在しています。私たちは、自分の細胞内で合成するヘムに加えて、食べ物に含まれる他の生物由来のヘムを消化・吸収したものを鉄源やヘム源として利用しています。これらのヘムはさまざまなタンパク質と結び付くことで、酸化還元反応や酸素運搬など生命活動に必須な生化学反応の多くを担っています。その代表例が、ヘムとグロビンタンパク質が結合したヘモグロビンです。一方で、タンパク質と結合していない遊離ヘムは活性酸素を産出するため細胞毒性をもつことも知られています。
ヒトの体内に侵入した病原菌は、ヘモグロビンから鉄を含んだヘムを奪い取って血中で増殖しますが、ヘモグロビンを分解する際に高濃度の遊離ヘムにさらされます。一部の細菌(グラム陰性細菌[1])は有毒な遊離ヘムを過剰に取り込まないように細胞膜の外側にバリア(外膜)を備えています。一方、外膜を持たない細菌(グラム陽性細菌)は、細胞内からヘムを排出する仕組みを進化させたと考えられています。
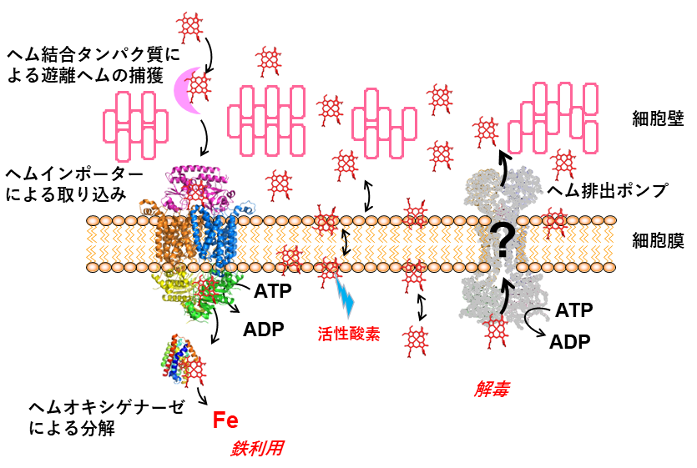
グラム陽性細菌の一種である黄色ブドウ球菌が持つhrtBA遺伝子[5]は、ヘムによって発現が誘導される遺伝子として2006年に発見され、その遺伝子産物は「ATP-binding cassette(ABC)トランスポーター」と呼ばれる膜タンパク質の一つであることがアミノ酸配列の解析から判明しています。また、HrtBAタンパク質がグラム陽性細菌に固有のタンパク質であることも分かっています。ABCトランスポーターは全ての生物が持つ膜タンパク質でATP[6]を使って物質を細胞内外に輸送する役割を担っています。hrtBA遺伝子を欠損した細菌は、ヒト血中に存在する遊離ヘム濃度に対しても感受性があることから、HrtBAタンパク質はグラム陽性細菌の細胞に侵入した過剰のヘムを排出するポンプであると推定されていました。しかし、HrtBAタンパク質はこれまでにタンパク質レベルで研究されておらず、ATPを使ってヘム排出する仕組みは不明のままでした(図1)。
図1 グラム陽性細菌のヘム利用と解毒のモデル
ヘムを取り込むヘムインポーターや、ヘムを分解して非ヘム鉄として利用するヘムオキシゲナーゼの機能・構造は明らかになっているが(左側、リボンモデルで表示したタンパク質分子)、ヘム排出ポンプと推定されたHrtBAタンパク質(右側、グレーのタンパク質)の仕組みは未解決のままであった。
研究手法と成果
まず共同研究グループは、HrtBAタンパク質がヘムの解毒能を持つのかを検証しました。分子生物学研究に一般的に用いられる大腸菌実験室株K12はヘムを通さない外膜に包まれているため、ヘムに耐性を持っています(図2A上段)。この大腸菌に組換えDNA技術[7]を用いて外来ヘムが細胞内に取り込まれるようにしたところ、増殖速度が低下したことから、ヘムがこの組換え大腸菌に対して有毒であることが確認できました(図2A中段)。このヘム感受性組換え大腸菌株にジフテリア菌由来のhrtBA遺伝子をさらに発現させたところ、増殖速度が回復しました。この結果から、HrtBAタンパク質が確かにヘムを解毒できることが分かりました(図2A下段)。
次に、HrtBAタンパク質の膜タンパク質としての性質を調べるため、この組換え大腸菌細胞膜から界面活性剤存在下でHrtBAタンパク質を可溶化・精製した後、脂質ナノディスク[8]に埋め戻すことで、HrtBAタンパク質だけが埋め込まれた擬似的な細胞膜を作製しました。こうして、ナノディスクに再構成したHrtBAタンパク質にヘムを添加したところ、HrtBAタンパク質のATP加水分解活性[6]が促進されることを確認しました(図2B)。また、HrtBAタンパク質にヘムを結合させた状態でATPを添加すると、HrtBAタンパク質からヘムが遊離することも分かりました(図2C,D)。
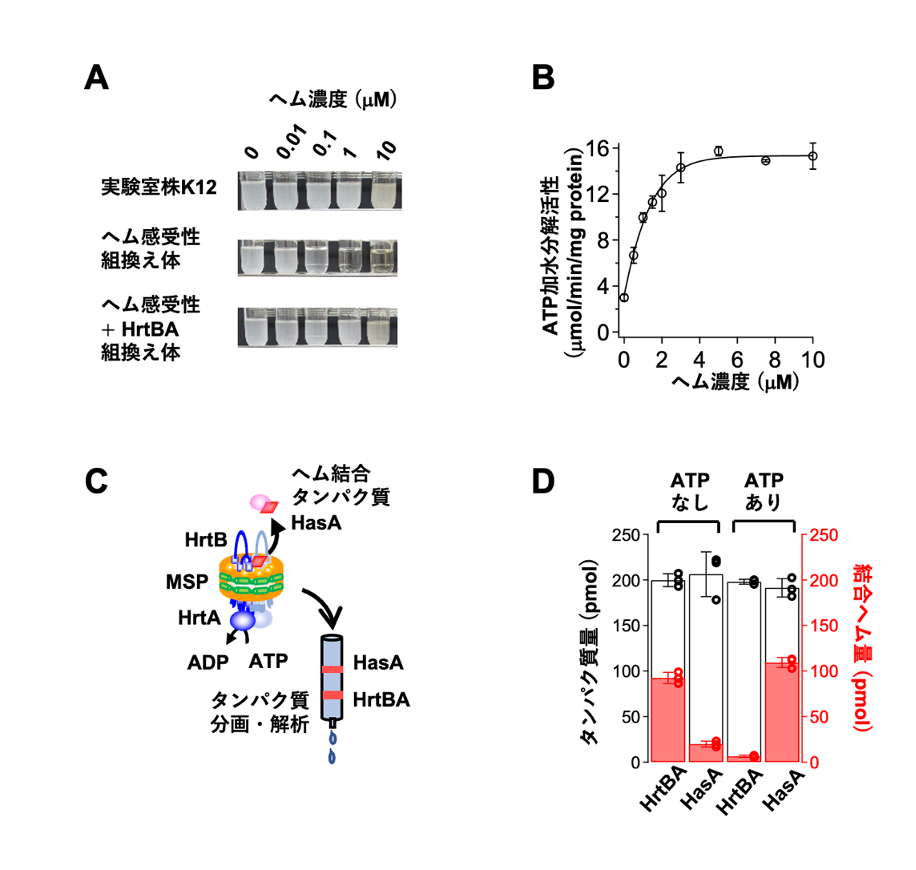
図2 HrtBAタンパク質の機能解析
(A)培地中の遊離ヘム濃度と大腸菌の増殖能の関係。白濁の試験管は大腸菌が高密度で増殖していることを示す。元の大腸菌実験室株K12はヘム非感受性であり、遊離ヘムの濃度が高い培養液でも増殖できる(上段)。ヘム感受性となった組換え体は濃度1および10マイクロモーラー(µM、1µ Mは100万分の1モーラー)のヘムで生育阻害が起こる(中段)が、これにさらにHrtBAタンパク質を発現させると生育できるようになる(下段)。
(B)ナノディスクに再構成したHrtBAタンパク質のATP加水分解活性は、ヘムによって促進される。縦軸はATP加水分解活性、横軸は遊離ヘム濃度を示す。
(C)HrtBAタンパク質に結合したヘムの解離を解析する実験系の模式図。ヘム、HrtBAタンパク質、およびヘム結合タンパク質であるHasAを同時に反応させた後タンパク質を抽出し、ATP非存在下あるいは存在下でヘムがHrtBAタンパク質とHasAタンパク質のどちらに多く結合しているかを調べ、その割合を解析する。MSPは、ナノディスク作製に用いた膜円盤形成タンパク質。
(D)実験系中の総タンパク質(黒線の棒グラフ)のうち、ヘムがHrtBAタンパク質とHasAタンパク質のどちらに結合しているか(赤の棒グラフ)を解析した結果。ATPが存在していない状況では、ほとんどのヘムがHrtBAタンパク質に結合しているが、ATPを添加するとHasAタンパク質の方に結合するようになった。これは、ATP結合によりHrtBAタンパク質のヘム結合の親和性が低下してヘムが解離し、その結果HasAタンパク質にヘムが転移したことを示す。
以上の結果から、HrtBAタンパク質はATPに依存してヘムとの結合状態を変化させていると考えられます。そこで、HrtBAタンパク質の立体構造を解析することで、この変化を詳細に調べることにしました。具体的には、ヘム結合型、ATPに類似した構造を持つATPアナログ[6](AMP-PNP)結合型、何も結合していないフリー型のHrtBAタンパク質の結晶を調製し、大型放射光施設「SPring-8」でX線による構造解析を行いました。
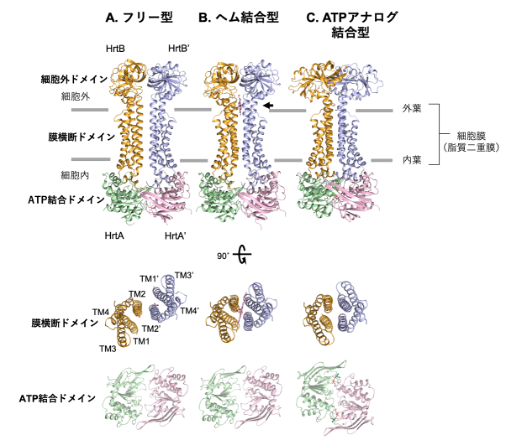
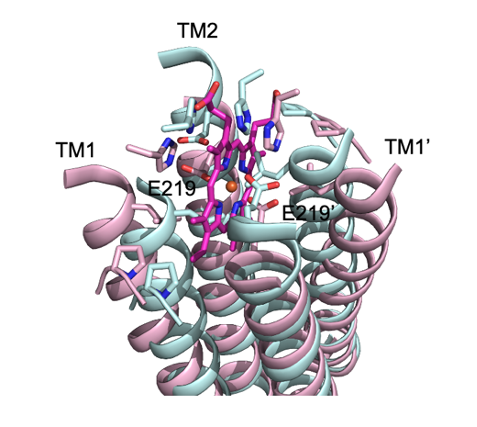
これらの立体構造解析から、HrtBAタンパク質の膜横断ドメイン[9]のヘム結合部位を明らかにするとともに、フリー型からヘム結合型への膜横断ドメインの構造変換およびATP加水分解酵素(ATPase)ドメインへのATP結合による膜ドメインの構造変換を視覚化することができました。ヘム結合部位は、細胞膜リン脂質二重膜の外葉表面付近にありました(図3B上段)。フリー型では、ヘム結合ドメインの膜横断ヘリックス[9]が横にずれており、細胞膜外側表面に位置するグルタミン酸がタンパク質表面に露出していました(図3A中段)。フリー型からヘム結合型になるときには、鉄原子にグルタミン酸が配位し、4本の膜横断ヘリックスがヘムを挟むように再配置していました(図3B中段)。
一方ATP結合型では、二つのATPase触媒部位にそれぞれATP(本実験ではAMP-PNP)が結合することで、触媒サブユニット同士が接触した二量体構造になっていました(図3C下段)。それに伴い、膜横断ドメインの4本の膜貫通ヘリックスが束ねられたバンドル構造となり、ヘム結合スペースが消失していました(図4)。
図3 HrtBAの結晶構造
HrtBAタンパク質は、hrtB遺伝子がコードするHrtBサブユニットとhrtA遺伝子がコードするHrtAサブユニットがペアとなり、このペアが二つ会合した構造をとる。会合相手のペアとなるサブユニットは「’」で示す。「SPring-8」で得られたHrtBAタンパク質の立体構造について、(A)フリー型、(B)ヘム結合型、(C)ATPアナログ結合型をそれぞれ示した。上段は膜に対して水平面から見た図、中段はHrtBサブユニットを上から見た図、下段はHrtAサブユニットを上から見た図。TMは膜横断ヘリックス。ヘム結合部位は←で示した(上段B)。
図4 ATP結合ドメインへのATP結合で誘起される膜横断ドメインの構造変化
HrtB膜横断ドメインのヘム結合部位を拡大した図。リボンモデルはタンパク質のヘリックス構造、リボンから突き出たスティックモデルはアミノ酸の側鎖、中央のスティックモデルはヘム、ヘム中央の赤丸は鉄をそれぞれ示す。タンパク質の構造変化は色の違いで表現しており、ピンクはヘム結合状態の構造、シアンはATP結合状態の構造を表す。サブユニットのATP結合ドメインにATPが結合することで、ATP結合ドメイン同士の会合が起こり(図3C下段)、膜横断ドメインのヘリックスの再配置が誘起される。ATPアナログ結合型では、ヘム結合部位はヘム結合スペースが消失する。E219は、ヘム結合型において鉄原子を配位する219番目のグルタミン酸の位置を示す。
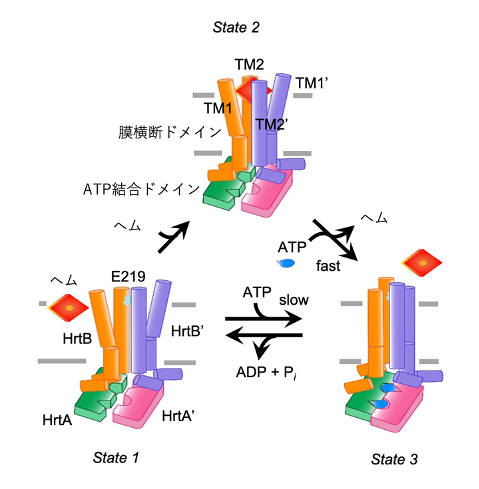
ヘムは水に溶けにくく油に溶けやすい脂溶性であることから、溶液中の遊離ヘムは容易に膜に侵入して膜構造を破壊したり、活性酸素種[10]を作り出したりするなど有害な作用を及ぼします。共同研究グループは今回の実験データから、HrtBAタンパク質によるヘムの排出は細胞質から細胞膜を透過させるのではなく、細胞膜から汲み出す、次の三つの反応で進むと考えました。
① HrtBAタンパク質がATPと結合していないときに細胞膜に侵入したヘムと結合し、膜から抜き取る。
② ヘムと結合したHrtBAタンパク質にATPが結合すると、HrtBAタンパク質の膜横断ドメインの構造変換によって結合していたヘムを排出する。
③ HrtBAタンパク質のATP加水分解活性によってATPが分解される。
こうして③の状態まで進むとHrtBAタンパク質の構造は①に戻り、ヘム排出ポンプの機能がターンオーバーするというモデルが導き出されました(図5)。
図5 HrtBAタンパク質がATP依存的に細胞膜からヘムを汲み出すモデル
ATPが結合していないHrtBAタンパク質は、細胞の外側から侵入しようとする遊離ヘムを膜から抜き取り(State 1)、ヘム結合型となる(State 2)。このとき、ATPase活性が活性化され、ヘム解離を促進してATP結合型(State 3)となる。ATP加水分解によって、ヘム結合・解離の反応が回転する。
今後の期待
グラム陽性細菌である黄色ブドウ球菌や連鎖球菌の血中での増殖は、敗血症や髄膜炎など重篤な病気を引き起こします。HrtBAタンパク質のヘム排出能を制御する薬剤は、これら病原菌の血中での増殖を抑制する働きが期待されることから、今回明らかになった構造情報を基にした薬剤のデザインや、機能解析に基づく薬剤スクリーニングは、新しい薬剤開発に貢献すると期待できます。
補足説明
[1] グラム陽性細菌、グラム陰性細菌
グラム陽性細菌はグラム染色によって細胞外被が紫色に染まる細菌群。薄赤に染まるグラム陰性細菌(大腸菌や緑膿菌など)が細胞膜、ペプチドグリカン層、外膜を持つのに対して、グラム陽性細菌は細胞膜とペプチドグリカン層を細胞外被として持つ。黄色ブドウ球菌、連鎖球菌、炭疽菌、乳酸菌などが属する。なお、ジフテリア菌やマイコバクテリアはグラム陽性細菌でありながら特異な外膜を持つことが知られているが、グラム陰性細菌の外膜と異なり、ヘムに対して透過性がある。そのため、これらの細菌の細胞膜も外来のヘムにさらされるのでHrtBAタンパク質を持っていると考えられる。
[2] ヘム、遊離ヘム
環状の有機分子(ポルフィリン)の一種プロトポルフィリンIXの中央に鉄がキレートされた金属錯体で、さまざまなヘム結合タンパク質(ヘムタンパク質)に結びついて働く補欠分子族。ヘモグロビンにおける酸素運搬やシトクロムにおける電子伝達など、多くの生物にとって重要な生体反応に関わっている。ヘムは水に溶けにくいため、生体内ではヘムタンパク質から遊離したヘムは脂質や他のタンパク質に弱く結合する。ここでは特異的にヘムタンパク質に結合していないヘムを「遊離ヘム」と呼ぶ。
[3] ABCトランスポーター
アデノシン三リン酸(ATP)を加水分解する際に得られる化学エネルギーを力学エネルギーに変換して、物質を輸送する膜タンパク質ファミリー。ATP-Binding Cassette (ABC)を共通の駆動源ユニットとして持ち、細菌から動物、植物にまで広く分布する。膜ドメインがそれぞれ多様に分化し、さまざまな物質を膜輸送する。
[4] SPring-8、X線結晶構造解析
「SPring-8」は、理化学研究所が兵庫県播磨地区で運用する世界最高性能のX線を発生させる大型放射光施設。数々のタンパク質構造解析に利用されている。X線結晶構造解析は、結晶化させた試料にX線を照射したときの回折パターンから電子密度分布を取得し、分子の立体構造を解析する方法。
[5] hrtBA遺伝子
黄色ブドウ球菌で見つけられたABCトランスポーターの遺伝子。膜横断サブユニットのHrtBとATP加水分解活性を持つサブユニットのHrtAからなるヘテロ四量体分子を作る。Hrtは、Heme Regulated Transporterの略。
[6] ATP、ATP加水分解活性、ATPアナログ
ATPは生物全般に存在するリン酸化合物の一つで、塩基と糖が結合した化合物(ヌクレオシド)に三つのリン酸が結合していることから、アデノシン三リン酸と呼ばれている。加水分解により一つのリン酸が解離すると、アデノシン二リン酸(ADP)となる。ATPに結合して加水分解を触媒するタンパク質の酵素活性をATP加水分解活性と呼び、この反応で得られたエネルギーはさまざまなタンパク質機能に利用される。ATPアナログはATPに類似した構造を持つ化合物を指し、本実験では加水分解されにくいATPアナログのAMP-PNPを用いて、ATPを結合した状態のタンパク質立体構造解析を行った。
[7] 組換えDNA技術
特定の遺伝子を取り出し加工した後、同種または異種生物細胞内に戻してそれら生物の性質を改変させる技術。本研究では、セラチア菌由来の外膜ヘム透過タンパク質の遺伝子chuAとジフテリア菌由来のヘム排出ポンプ遺伝子hrtBAをプラスミドにクローニングして、大腸菌K12株に移入した。
[8] ナノディスク
膜円盤形成タンパク質(Membrane Scaffold Protein)を用いて、生体膜構成成分であるリン脂質二重膜層を直径10ナノメートル(nm、1nmは10億分の1メートル)ほどの円盤状に囲い込む膜タンパク質再構成系。同時に、膜タンパク質を脂質膜に埋め込むことができる。
[9] ドメイン、ヘリックス
タンパク質の中で、まとまった構造・機能を示す領域をドメインと呼ぶ。ヘリックスはタンパク質の主要な二次構造の一つで、タンパク質の一部がらせん構造をとったもの。膜タンパク質には、複数のヘリックスが束になって膜を貫通しているものが多い。
[10] 活性酸素種
酸素は反応性に富むものの、生体内では比較的穏やかであるが、ヘムなど他の物質から不対電子を受け取ると一気に反応性が高くなる。スーパーオキシド、ヒドロキシラジカル、一酸化窒素などがあり、フリーラジカルと呼ばれる。ラジカルではないが、過酸化水素やオゾンも活性酸素種に属する。活性酸素種は生体内で重要な核酸、タンパク質、脂質に酸化的障害を与えるために有毒である。
共同研究グループ
理化学研究所
生命機能科学研究センター タンパク質機能・構造研究チーム
特別嘱託研究員 中村 寛夫 (ナカムラ・ヒロオ)
専任研究員 久野 玉雄 (ヒサノ・タマオ)
チームリーダー 白水 美香子 (シロウズ・ミカコ)
放射光科学研究センター 生命系放射光利用システム開発チーム
専任研究員 當舎 武彦 (トウシャ・タケヒコ)
兵庫県立大学 大学院理学研究科 生命科学専攻
特命教授 城 宜嗣 (シロ・ヨシツグ)
大学院生 マフーズ・ラーマン(Md. Mahfuzur Rahman)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)理化学研究所奨励課題「ヘムは栄養となるのか?毒となるのか?:ヘム毒性を解毒する病原菌のヘム排出ポンプの研究(研究代表者:中村寛夫)」、RIKEN Pioneering Projects「Dynamic Structural Biology by Integrating Physics, Chemistry, and Computational Science Research(研究分担者:白水美香子)」、RIKEN Pioneering Projects「Molecular Systems Research(研究分担者:城宜嗣)」で実施し、日本学術振興会(JSPS)科学研究費補助金基盤研究(C)「ヘムを解毒する病原菌のヘム排出ポンプの構造・機能解析(研究代表者:中村寛夫)」、同基盤研究(C)「ジフテリア菌ヘムセンサーのヘム受容の分子機序(研究代表者:中村寛夫)」、同基盤研究(S)「一酸化窒素の生体内動態の分子科学(研究代表者:城宜嗣)」による支援を受けて行われました。
発表者・機関窓口 |
- 現在の記事
- 病原菌はヘムを解毒して血中で増殖する -敗血症や髄膜炎の薬剤開発に貢献する膜タンパク質の解析-(プレスリリース)
 sci.u-hyogo.ac.jp(城)
sci.u-hyogo.ac.jp(城)