自然免疫受容体TLR3はdsRNA上で多量体を形成し効率的なシグナル伝達を行う(プレスリリース)
- 公開日
- 2023年01月17日
- クライオ電子顕微鏡
2023年1月17日
東京大学
理化学研究所
横浜市立大学
発表のポイント:
◆二本鎖RNA(dsRNA)をリガンドとする自然免疫受容体TLR3と長鎖のdsRNAとの複合体構造をクライオ電子顕微鏡単粒子解析により構造決定した。この結果dsRNAに沿ってTLR3がクラスター化して結合することを明らかにした。
◆クラスター化したTLR3の相互作用界面には電荷を有するアミノ酸が集まっており、変異体を用いた活性測定により静電相互作用がクラスター形成に重要な働きをしていることを明らかにした。
◆TLR3の多量体形成によって細胞内のTIRドメインまたはそれを介した下流のアダプター分子の局所濃度が上昇することで、より効率的なシグナル伝達が可能となると考えられる。
【研究の背景】
Toll様受容体 (TLR) は、自然免疫を活性化させる1回膜貫通タンパク質であり、細菌やウイルスに由来する病原体関連分子パターンの認識により活性化されることで細胞内へシグナルを伝達し、炎症性サイトカイン[注1]やインターフェロン[注2]の産生を誘導する。ヒトではTLR1-10の10種類が同定されている。
TLR3は、リソソーム[注3]に局在し、主としてウイルスに由来する二本鎖RNA (double-stranded RNA、 dsRNA) を認識する。これまでの研究により、最短でおよそ40塩基対 のdsRNAを介して二量体を形成することが明らかにされている。また、より長鎖のdsRNAによって、活性化が増強されることが示されているが、その機構については不明な点が多かった。
【研究内容】
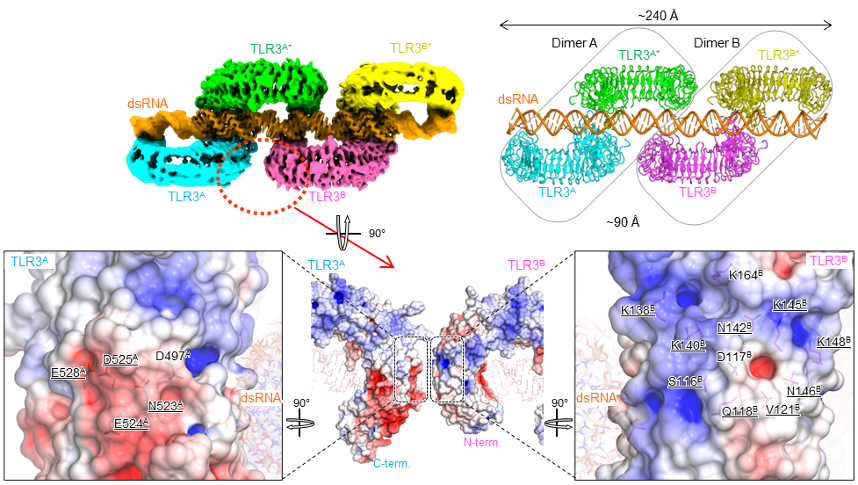
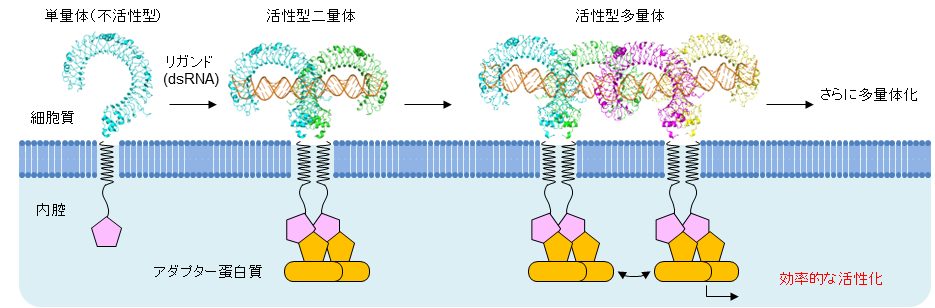
本研究グループは、TLR3細胞外ドメイン試料と90 塩基対の dsRNAとの複合体構造をクライオ電子顕微鏡単粒子解析[注4]により構造決定した。既報の二量体構造2つがdsRNAに沿って約90 Åの並進移動により配置されていた。各プロトマーは側方のプロトマーと隣接した状態でdsRNAを認識していた(図1)。より長鎖のdsRNAに対してはさらに高次の多量体を形成することも確認した。2つの二量体間は約8 Å離れていたが、相補的な表面電荷を有しており、静電相互作用により多量体形成が促進されている可能性がある。このことを確認するため、二量体単位間の近接領域に存在する電荷をもつアミノ酸に特に注目し、電荷を反転させるような変異を導入して細胞を用いて活性測定を行い、さらにクライオ電子顕微鏡により、変異体の多量体状態を観察した。これらの変異体は活性が有意に低下し、多量体形成能も低下しており、静電相互作用がクラスター形成に重要な働きをしていることが明らかになった。本研究より、TLR3がdsRNAの長さ依存的に多量体形成をすること、この多量体形成がシグナル伝達において有利に働くことが示された。これは、TLR3の多量体形成によって細胞内のTIRドメイン[注5]またはそれを介した下流のアダプター分子の局所濃度が上昇することでより効率的なシグナル伝達が可能となるためであると考えられる(図2)。
【研究の意義と今後の展開】
TLR3 は感染防御や抗腫瘍応答及びウイルスによる炎症性疾患に深く関わっており、TLR3 のシグナル増強剤及びシグナル抑制剤が待ち望まれている。今回、dsRNAに沿ったTLR3のクラスター化がシグナル伝達の活性を増強させていることがわかったことから、TLR3のクラスター化を防ぐような化合物はシグナル抑制剤として期待できる。
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業(CREST)(課題番号 JPMJCR21E4)、AMED創薬等先端技術支援プラットフォーム(BINDS) (課題番号 JP21am0101115、 JP21am0101070、 JP22ama121023)、JSPS科研費JP22H05182、などの外部資金支援を受けて行われた。
発表雑誌:
雑誌名:Nature Communications
論文タイトル:TLR3 forms a laterally aligned multimeric complex along double-stranded RNA for efficient signal transduction
著者:Kentaro Sakaniwa、 Akiko Fujimura、 Takuma Shibata、 Hideki Shigematsu、 Toru Ekimoto、 Masaki Yamamoto、 Mitsunori Ikeguchi、 Kensuke Miyake、 Umeharu Ohto and Toshiyuki Shimizu
DOI番号: 10.1038/s41467-023-35844-2
図1:TLR3とdsRNAとの複合体構造
dsRNAに沿ってTLR3がクラスター化して多量体を形成している(上図)。この構造は既報の二量体構造(上図右で四角で囲んである)が並進したものとなっている。TLR3の相互作用界面には電荷をもったアミノ酸が集まっており(下図)、変異体を用いた活性測定により静電相互作用がクラスター形成に重要な働きをしていることを明らかにした。
図2:多量体形成による効率的な活性化
TLR3はリガンドがない状態では単量体(不活性型)として存在しているが、dsRNAがくると活性型二量体となる。長鎖dsRNAではさらに多量体形成してより効率的な活性化を引き起こすことが可能になると考えられる。
【用語解説】
[注1] 炎症性サイトカイン
サイトカインとは、細胞同士の情報伝達にかかわるさまざまな生理活性を持つタンパク質の総称。炎症性サイトカインとは、体内への病原体の侵入を受けて産生されるサイトカインで、生体防御に関与する多種類の細胞に働き、炎症反応を引き起こす。
[注2] インターフェロン
細菌やウイルスなどの病原体の侵入に対して免疫系の細胞が分泌するタンパク質で、ウイルスの増殖を抑制する作用や免疫系を活性化する作用を発揮する。
[注3] リソソーム
リソソームは真核生物の細胞小器官の一つであり、細胞内外成分の分解機能を担う。TLR3を含む核酸認識TLRはリソソームに局在している。
[注4] クライオ電子顕微鏡単粒子解析
タンパク質の立体構造を高分解能で決定するための手法の一つ。電子線照射による分子の振動や損傷を抑えるために、観測対象のタンパク質を氷薄膜中に包埋し、マイナス 180 度の低温に保ったまま電子顕微鏡像を観測する。数十万から数百万分子の投影像を分類・平均化し、それらを統合して高分解能の三次元構造を構築する。
[注5] TIRドメインとアダプター分子
哺乳類のインターロイキン 1 (IL-1)受容体とショウジョウバエTollの間の相同性から同定されたドメインであり、TLRは細胞内にこのドメインを有する。TLRにリガンドが結合し活性化すると、細胞内に存在するアダプター蛋白質と呼ばれる蛋白質がTIRドメインを介して数多く会合してシグナル伝達を行うと考えられている。
問い合わせ先: |
- 現在の記事
- 自然免疫受容体TLR3はdsRNA上で多量体を形成し効率的なシグナル伝達を行う(プレスリリース)
 mol.f.u-tokyo.ac.jp
mol.f.u-tokyo.ac.jp