多価陽イオンによってイオン電流が調節される仕組みを解明 ~思考や記憶等の元になる神経伝達の調節機構についての知見~(プレスリリース)
- 公開日
- 2023年07月31日
- BL32XU(理研 ターゲットタンパク)
- BL41XU(生体高分子結晶解析 I)
2023年7月31日
国立大学法人東海国立大学機構 名古屋大学
和歌山県立医科大学
国立大学法人金沢大学
【ポイント】
⚫︎神経活動の調節に重要な電流調節の仕組みに関する研究
⚫︎親水性の増加によるカルシウムイオンによる電流阻害が起きることの発見
⚫︎多価イオンの挙動をシミュレーションで正確に再現
和歌山県立医科大学薬学部の入江 克雅 准教授(名古屋大学細胞生理学研究センター 客員准教授)は、国立大学法人東海国立大学機構 名古屋大学細胞生理学研究センター・大学院創薬科学研究科・糖鎖生命コア研究所の大嶋 篤典 教授、織田 祥徳 博士後期課程学生らの研究グループ、金沢大学ナノ生命科学研究所の炭竈 享司 特任助教(JSTさきがけ研究員)、東京医科歯科大学との共同研究で、神経情報伝達や記憶形成などで重要な役割を担う二価陽イオンによるイオンチャネルの電流調節の仕組みを、遺伝子変異による機能改変・結晶構造解析・分子動力学シミュレーション注1)を用いることで明らかにしました。 【論文情報】 |
【研究背景と内容】
発達障害の一種であるアスペルガー症候群や注意欠如・多動症(ADHD)は、自閉症スペクトラム障害とも呼ばれ、障害と健常の境目が明確ではありません。そのため、いわゆる“大人のADHD”といった顕在化しにくい症状を10人に1人程度が持つとされます。これらは日常生活の生きづらさの原因になるなど、うつ病などの精神疾患の遠因となります。そのため、これらの障害に関連する分子を標的とした薬剤の創製は、万人が少なからず抱える不安や悩みの解消の助けとなります。
これらの症状は障害と健常の境目が分かりにくく生じる仕組みは複雑ですが、神経活動の変化が原因と考えられます。神経活動では、神経細胞への刺激の発生が必須であり、この刺激を作り出すNMDA受容体注2)やAMPA受容体注3)という分子は、抗てんかん薬や抗アルツハイマー病薬の標的としても知られているイオンチャネルです。近年、これらの分子が自閉症スペクトラム障害にも影響することが明らかになりました。これらの分子は、電気信号の元となるイオンの流れであるイオン電流を生み出す分子であり、カルシウムイオンやマグネシウムイオンといった二価陽イオンが、イオンチャネルを流れるイオン電流を調節することが知られています。この調節に作用する薬剤には、メマンチンや、ケタミン・フェンサイクリジンなど、有用性が認められるものの幻覚作用といった強い副作用もあります。そこで、より良い薬剤の開発が期待されていますが、二価陽イオンがどのようにイオン電流を調節するかは分かっていませんでした。
NMDA受容体やAMPA受容体のようなイオンを通す分子はイオンチャネルと呼ばれ、これらが生み出すイオン電流は、我々人間から単細胞生物である細菌まで、すべての生物に共通する情報伝達の手段です。我々は、細菌のイオンチャネルが、高等生物のイオンチャネルよりも単純な形をしていることに注目し、細菌のイオンチャネルをカルシウムイオンやマグネシウムイオンによる電流調節を受けるように改変しました。単純な形をしている細菌のイオンチャネルは、構造解析が容易であり、電流調節がどのようにして生じるかを詳しく調べることができます。
X線結晶構造解析注4)では、1ナノメートル(nm)よりも小さいものを見分けることができます。そこで、大型放射光施設SPring-8のビームラインBL32XUとBL41XUを用いてX線回折実験を行いました。これによって、改変したイオンチャネルではイオンを通す1nm以下の小さな穴であるイオンポアにカルシウムイオンが詰まっていることを明らかにしました。このカルシウムイオンが詰まる原因は、改変のためにイオンチャネルに導入した親水的な変異アミノ酸によるものでした。すなわち、親水的なアミノ酸をイオンポアに導入すると、カルシウムイオンがイオンポアを塞ぐということです。その結果、ナトリウムイオンの流れが妨害され、イオン電流を減少させるという仕組みが示唆されました。結晶構造は、ある一瞬をとらえた静止画です。そのため、結晶構造が示すカルシウムイオンによるイオンポアの閉塞がどの頻度で生じ、どの程度ナトリウムイオンがイオンポアを通れなくなるかを検証する必要があります。水に溶けたイオンは、1ナノ秒よりもはやい速度で周囲の水分子と結合と解離を繰り返しながら水中を移動しています。そこで、自然科学研究機構・岡崎共通研究施設のスーパーコンピューターを用いた分子動力学シミュレーションによって、カルシウムイオンとナトリウムイオンの振る舞いを調べました。分子動力学シミュレーションでは2フェムト秒ごとの分子の位置を計算するので、イオンの挙動を詳細に調べることができます。シミュレーション結果により、改変したチャネルでは高頻度にカルシウムイオンがイオンポアに詰まり、それによりナトリウムイオンの通り抜けが邪魔されていることを確かめました。
以上のことから、イオンポア内の親水性を高めると、カルシウムイオンなどの二価の陽イオンが詰まりやすくなり、その結果イオン電流が生じにくくなることが明らかになりました。
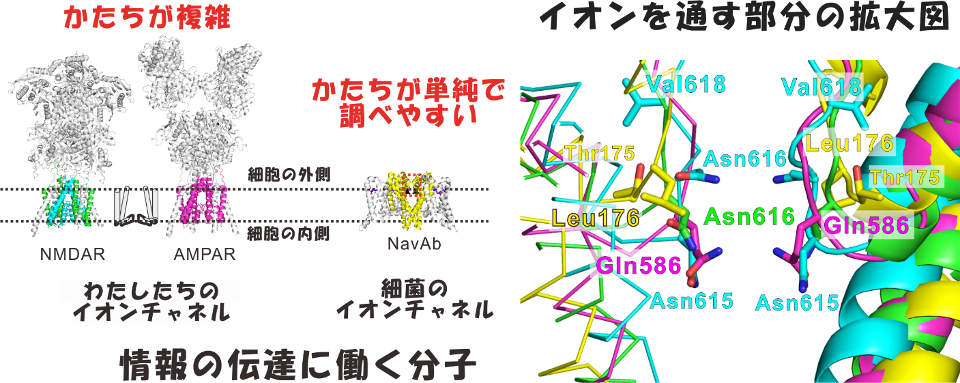
図1.高等生物と細菌のイオンチャネルの比較。
左)高等生物で神経活動の起点となる活動電位の発生を担うイオンチャネル(NMDA受容体やAMPA受容体)と細菌のイオンチャネルで最も構造解析が進んでいるNavAbの比較。
右)NMDA受容体やAMPA受容体とNavAbのイオンの通り道であるイオンポア部分を重ね合わせて比較した図。NMDA受容体のマグネシウムイオンによる電流調節に関わるアミノ酸残基である615番目と616番目のアスパラギン残基(Asn615,Asn616)やAMPA受容体の586番目のグルタミン残基(Gln586)がNavAbの176番目のロイシン残基(Leu176)と重なる位置にある。NavAbのLeu176をグルタミンやアスパラギンに変異させるとカルシウムイオンやマグネシウムイオンによる電流の減少が起きた。
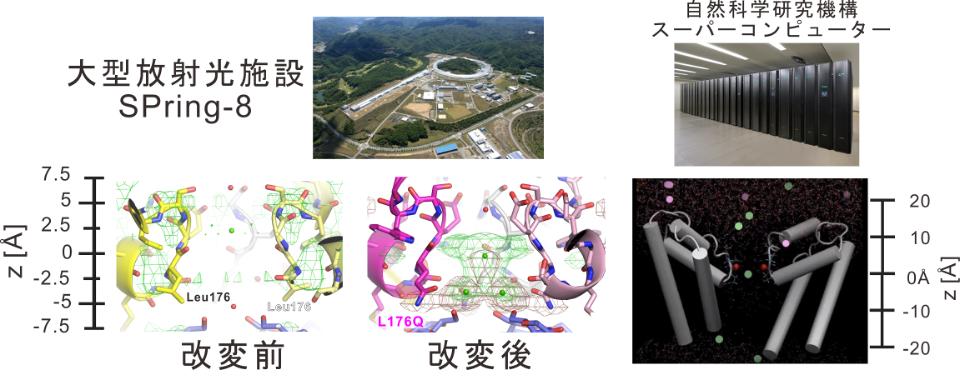
図2.改変チャネルの結晶構造解析と分子動力学シミュレーション
左)大型放射光施設SPring-8を用いた回折実験で得られたカルシウムイオンによる電流減少が起きない改変前のNavAb(黄色)とL176Q変異導入した改変NavAb(紫)のイオンポアの比較。改変前のチャネルではイオンの通り道にカルシウムイオンに由来する緑色のメッシュは観察されなかったが、改変チャネルでは通り道を塞ぐような緑色のメッシュが観察された。
右)分子動力学シミュレーション中にみられたカルシウムイオン(緑丸)がイオンの通り道を塞ぎナトリウムイオン(桃丸)が通れなくなる様子。
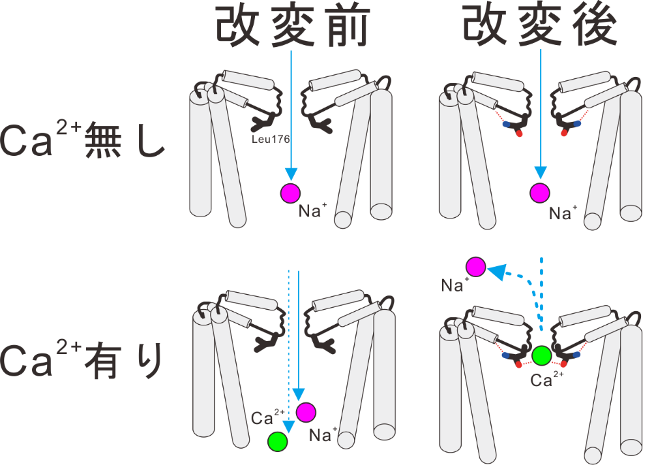
図3.今回の研究で明らかになった多価陽イオンによる電流阻害の分子モデル
カルシウムイオンのような多価陽イオンがないときはイオンの通り道に強くとどまるイオンは存在せず、どちらのイオンチャネルでもナトリウムイオンの通り抜けが起き、イオン電流が発生する。改変前のチャネルでは、イオンポア内の親水性が低いため、カルシウムイオンがイオンポア内に強くとどまることができないため、カルシウムイオンによる電流の減少は起きない。一方で、イオンポア内の親水性が増加した改変チャネルでは、増加した親水性によってカルシウムイオンが強くイオンポア内にとどまるため、ナトリウムイオンが通れなくなりイオン電流が減少する。
【成果の意義】
MDA受容体は、神経活動に関わるイオンチャネルであるため、構造研究が盛んに行われており、薬剤が結合した構造など様々な構造が明らかになっていますが、マグネシウムイオンが結合した構造は得られておらず、マグネシウムイオンがどのようにイオン電流を阻害するかの詳細は分かっていませんでした。
今回の研究では、元々カルシウムイオンやマグネシウムイオンによって電流減少が起きない細菌のイオンチャネルに電流減少を起こす改変を加えることで、どのような変化が電流減少を引き起こすかを直接的に知ることができます。今回の結果は、イオンポア内の親水性の増加が、二価陽イオンをイオンポア内にとどめることを示しました。これまで、多価イオンの挙動は分子動力学計算では再現が困難でした。本研究では、このイオンの挙動の最適化の検討も行っており、カルシウムイオンの挙動を正しく再現することに成功しています。この結果は、これまで再現が困難だった多価イオンが関わる生命現象のシミュレーションでの再現にも貢献します。
本研究は、文部科学省科学研究費補助金 (17K17795, 20K09193)、日本医療研究開発機構「創薬等ライフサイエンス研究支援基盤事業」、公益財団法人 住友電工グループ社会貢献基金、武田科学振興財団薬学系研究助成、公益財団法人発酵研究所一般研究助成、令和4年度和歌山県立医科大学特定研究助成プロジェクト、文部科学省世界トップレベル研究拠点プログラム(WPI)の支援を受けて行われました。
【用語解説】
注1)分子動力学シミュレーション: 分子の動的な構造変化を計算機内で再現し追跡する手法。分子力場を用いて、目的分子を含む系内のすべての原子に働く力を求め、これを用いて原子の軌跡を決定する。
注2)NMDA受容体: 神経伝達物質であるグルタミン酸のイオンチャネル型受容体の一種。グルタミン酸で活性化される受容体はいくつかあり、NMDA受容体はグルタミン酸のほかにもNMDA(N-メチル-D-アスパラギン酸)でも活性化されることからこの名前が付いている。この受容体は、活性化すると陽イオンを通すイオンチャネルとして機能し、学習、記憶、思考などの重要な脳の機能に関与している。この受容体はほかのグルタミン酸の受容体とは異なり、神経細胞が一定の刺激を受けることでのみ活性化されるという特性を持つ。一定の刺激を受けるまではマグネシウムイオンが活性を阻害していることが知られている。
注3)AMPA受容体:NMDA受容体と同じくグルタミン酸を受容するイオンチャネル型受容体の一種。グルタミン酸のほかにもAMPA(α-アミノ-3-ヒドロキシ-5-メチル-4-イソキサゾールプロピオン酸)で活性化することからこの名前が付けられた。AMPA受容体もグルタミン酸が結合することで、陽イオンを通すイオンチャネルとして機能し神経細胞の活動電位の発生に関与する。
注4)X線結晶構造解析: タンパク質の構造解析法の1 つ。X 線をタンパク質の三次元結晶に照射して回折像を収集し、そのデータをコンピューターによって解析することで、タンパク質の立体構造を得る手法。
【研究者連絡先】 |
- 現在の記事
- 多価陽イオンによってイオン電流が調節される仕組みを解明 ~思考や記憶等の元になる神経伝達の調節機構についての知見~(プレスリリース)
 cespi.nagoya-u.ac.jp
cespi.nagoya-u.ac.jp