人工知能で胃酸抑制剤の候補をデザイン ~AI×化学×電子顕微鏡で創薬に新たなフロー~(プレスリリース)
- 公開日
- 2023年09月29日
- クライオ電子顕微鏡
2023年9月29日
国立大学法人東海国立大学機構 名古屋大学
株式会社理論創薬研究所
株式会社インテージヘルスケア
公益財団法人高輝度光科学研究センター
【本研究のポイント】
・人工知能(AI)で胃酸抑制剤の候補となる新しい化合物をデザイン。
・電子顕微鏡で化合物の結合状態を「視」て改良。
・いくつかの既存薬を上回る阻害活性を達成。
・「AI×化学×電子顕微鏡」の融合は、他のターゲットに対する創薬への応用も期待。
|
国立大学法人東海国立大学機構 名古屋大学細胞生理学研究センターの阿部 一啓 准教授、大学院創薬科学研究科の横島 聡 教授らの研究グループは、株式会社理論創薬研究所の吉森 篤史 博士、株式会社インテージヘルスケア、大型放射光施設SPring-8との共同研究で、AI、有機化学、構造生物学を活用し、胃酸抑制剤の候補となる新しい化合物の創生に成功しました。 【論文情報】 |
【研究背景と内容】
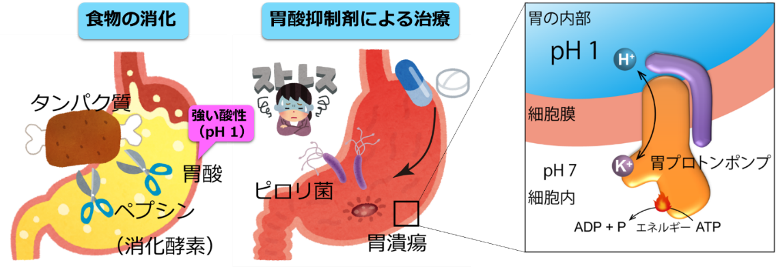
食物消化時に分泌される胃酸によって、我々の胃の内部は強い酸性(pH1)になります。胃の表面は粘膜によって保護されているので傷つくことは稀ですが、暴飲暴食や肉体的精神的ストレスによって粘膜が減少したり、ピロリ菌の感染によって粘膜が損なわれたりすると、胃酸は自分自身を傷つけてしまします。これが不快な胸焼けや、ひどい場合には胃潰瘍や逆流性食道炎と言われる症状の原因です。この治療の為には、単純明快、胃酸の出る元を閉じてやればよい訳です。この胃酸の出る元、強い酸性の原因である水素イオン(H+)を出しているのが、胃の表面に存在する「胃プロトンポンプ」と呼ばれるタンパク質です(図1)。
図1 胃のはたらき 胃酸の分泌は食べ物の消化に重要ですが、胃酸の胃粘膜分泌のバランスが崩れると胃潰瘍や逆流性食道炎といった症状を呈する。このような胃酸分泌を担うのが、胃の表面に発現している膜タンパク質、胃プロトンポンプ(H+,K+-ATPase)である。
この「胃プロトンポンプ」の働きを阻害する薬剤は、胃酸抑制剤と呼ばれます。オメプラゾールに代表される「プロトンポンプインヒビター(PPI)」や、ボノプラザンに代表される新しいクラスの薬剤「K+拮抗型アシッドブロッカー(P-CAB)」が実際の治療に使われています。これらの薬剤はまた、胃癌の主原因とされるピロリ菌を除菌する際に、抗生物質の効き目を担保する為に胃酸を中和する目的でも使用されます。このほかにも様々な用途で使用され、その世界市場の規模は年間2兆円とも言われています。より迅速で確実な治癒の為に、また効き目の個人差を減らす為、未知の副作用や他の薬物との相互作用を回避する為に、既存の薬剤とは大きく異なる化学構造を持った薬剤を開発することは、治療の選択肢を広げることに繋がるので重要です。
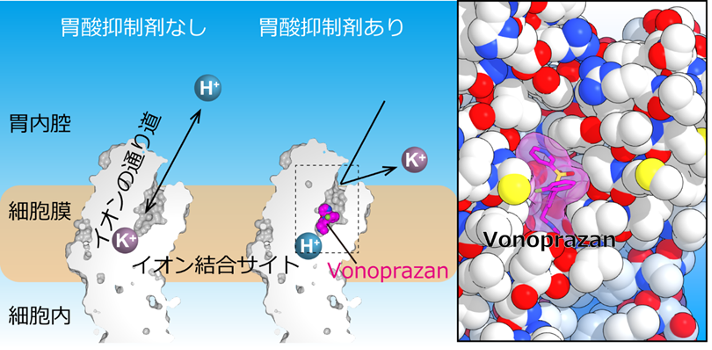
図2 胃酸抑制剤の作用機序 胃酸抑制剤は胃プロトンポンプのイオンの通り道に結合、
「ブロック」することで胃酸が分泌されるのを防ぐ(Abe et al, 2018, Nature)。
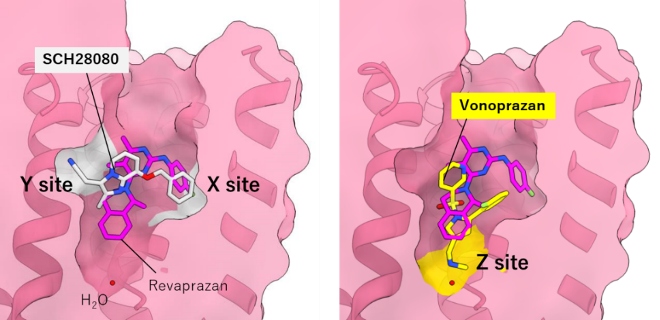
研究グループは、これまでに複数の胃酸抑制剤が胃プロトンポンプに結合した状態を、X線や電子顕微鏡を使って調べることで、既存の薬剤や阻害剤がタンパク質のどの部分に結合しているかという情報を得ていました。これらの薬剤は全てH+の通り道に結合して、これを塞ぐことで酸を「ブロック」します(図2)。しかし、化合物によって結合する場所が少しずつ違っています。例えばP-CABのプロトタイプ化合物として知られるSCH28080はXとYの二箇所で結合していますが、vonoprazanはXとYとは異なる領域Zを介して結合している、といった具合です(図3)。では、その場所(X, Y, Z)全部に結合できる新しい化合物があれば、もっと強く結合できるのではないか?というのが、この研究の発端です。
図3 胃酸抑制剤の結合部位 胃プロトンポンプの薬剤結合ポケットの拡大図。SCH28080はX、Yを拠り所として結合しているが(白)、Vonoprazanはそれよりもポケットの奥のZに結合している(黄色)。Revaprazan(マゼンタ)は白と黄色の両方に渡って結合しているが、ポケットの壁から遠く、ピッタリと結合していないので、他の2つの化合物と比べて親和性が低い(Tanaka et al, 2022, J Med Chem)。
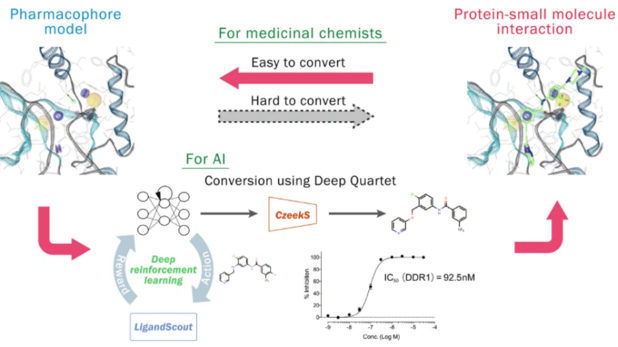
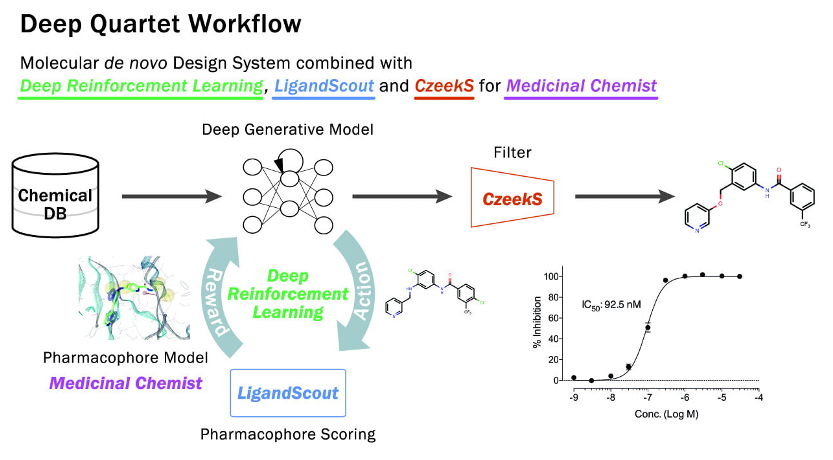
結合する場所が分かっても、そこにちょうどいい塩梅に結合できる化合物を考えるのは、普通の人間には簡単なことではありません。よく行われる方法は、既存の薬剤/阻害剤の構造を参考にして、官能基注4)を加えたり変更したりして、より高い親和性のものを作り出すという方法です。しかしこの方法では、化合物の骨格に起因する副作用や薬物動態の大幅な改善が望めないことがあり、そもそも良いものが得られたとしても特許によってその化合物を利用できないことがあります。従って、既存の化合物とはまったく異なるユニークな構造の化合物をデザインすることが望まれます。研究グループは、この問題解決にAIを活用しました。(株)インテージヘルスケアと(株)理論創薬研究所の吉森 篤史 博士らは、機械学習を応用してde novo(「あたらしい」の意)化合物をデザインできるソフトウェア「Deep Quartet(DQ:ディープカルテット)」を開発してきました(図4)。この方法を使って、胃プロトンポンプ構造の任意の場所に結合部位(ファーマコフォアフィーチャー)を複数指定し、これを繋ぐ化合物をデザインしました。
図4 人工知能を利用したドラッグデザインプラットフォーム「Deep Quartet」
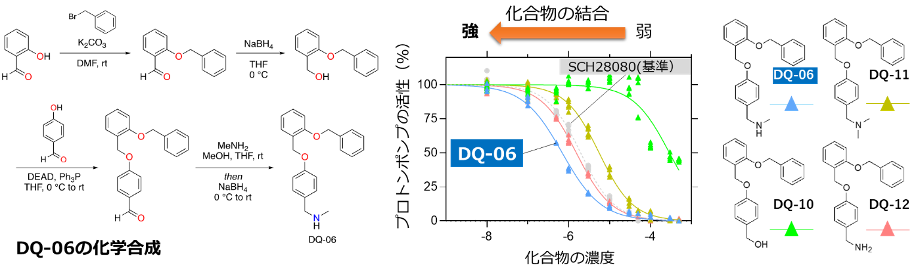
DQによってデザインされた百数十の候補の中から、有機化学、構造生物学の観点から適していると考えられるもの(指定したファーマコフォアとの一致具合、化学合成の難易度、想定される側鎖との相互作用、合成可能な化合物であること、など)を選び出し、実際に化合物を合成、胃プロトンポンプの活性阻害を指標として、その化合物の親和性(どれくらい強く結合するか)を調べました。すると6番目に合成した化合物(DQ-06)が、基準となる化合物(SCH28080)よりも強く結合することが分かりました(図5)。
図5 化合物の合成と親和性の測定 DQ-06の合成スキーム(左)。化合物によるのプロトンポンプ活性阻害の濃度依存性(右)。プロトンポンプの活性(%、縦軸)を、加えた化合物の濃度に対してプロットした。基準の化合物(SCH28080, 灰色)とくらべ、DQ-06は低濃度で活性を阻害することが分かる。この図の曲線が左にいくほど、その化合物による結合が強いと考えることができる。
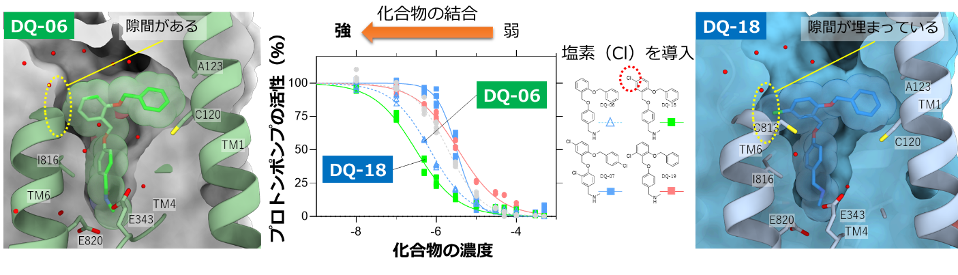
DQ-06は実際にはどのように胃プロトンポンプに結合しているのか?研究グループはクライオ電子顕微鏡を使って、化合物の結合状態を「視る」ことにしました。大型放射光施設SPring-8に設置された共用電子顕微鏡によって2.08Åという高分解能で化合物を視ることに成功しました。この結果によって、化合物が想定通りに結合していることが確認された一方で、化合物と結合ポケットの間には隙間があることを見つけました(図6左)。
図6 化合物の改良 DQ-18の結合構造(左)から、ポケットに隙間があることを見つけた。この位置に塩素原子を1つだけ導入した化合物(DQ-18)は、もとの化合物(DQ-06)よりも強く結合することが分かった(中央)。実際に構造を視ると(右)隙間が塩素原子で埋まっていて、ポケットによりピッタリとはまっていることが分かる。
この隙間を埋めてやれば、化合物がもっとピッタリとポケットに収まるので、強く結合するはずです。研究グループは、DQ-06に塩素原子(Cl)を1つ導入した、少し大きめの新しい化合物DQ-18を合成しました。予想通りDQ-18はポケットに隙間なくピッタリとハマっていて、結合力も強くなりました。(図6右)。
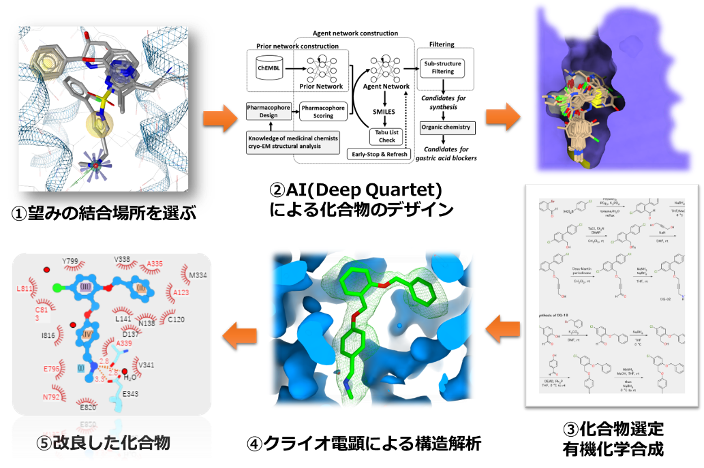
図7 AIを利用した薬剤デザインのスキーム
このように(図7)、①既存のタンパク質構造から薬剤の結合に重要な部分を選び出す。②結合に重要な部分を満たす新規化合物をAIによってデザインする。③化学的な視点から適切なものを選び出し化学合成する。④化合物の結合構造をクライオ電子顕微鏡で見る。⑤さらに改良を加える。というステップを経ることで、胃酸抑制剤のプロトタイプ化合物であるSCH28080と比べて10倍近く親和性の高い化合物を創製することに成功しました。
【成果の意義】
AIを活用したドラッグデザインの中でも、今回の報告は、難易度の高い膜タンパク質を対象として、AIによりデザインされた化合物を実際に合成し、その結合状態を実験的にクライオ電子顕微鏡で決定、さらに構造情報に基づいた化合物の改良を達成した初めての例です。この枠組み(AI×化学×電子顕微鏡)は胃プロトンポンプに対する胃酸抑制剤だけでなく、創薬ターゲットの半分以上を占めると言われる多くの膜タンパク質を含む、ほかの様々なドラッグターゲットへの応用が期待されます。
【各研究者による成果へのコメント】
◆国立大学法人東海国立大学機構 名古屋大学細胞生理学研究センター 阿部 一啓 准教授
共同研究開始直後、いきなり2番目の化合物が有意な阻害活性を示し、さらには6番目の化合物が、基準となる化合物(SCH28080)の親和性を既に上回ったことが大きな驚きで、創薬として驚異的なヒット率を実感しました。そのAIがデザインした化合物を、構造解析によって「人の手で」さらに改良できたときは、まだまだAIには負けないぜ!というちょっとした嬉しさもありました(笑)。今回の仕事は人間がAIをどういう風に利用するかという良い例になったと思っています。構造生物学者の中には、実際に薬剤結合構造を解析したけれど、どうやって新規化合物をデザインするか悩んでいる方も多いと思います。この枠組みは、他の構造既知のターゲットにも応用できると感じています。
◆国立大学法人東海国立大学機構 名古屋大学大学院 創薬科学研究科 横島 聡 教授
提示された構造をこの世に存在させることが、有機合成化学に課せられる何よりも重要な役割ですが、合成可能性を含めた候補化合物の検討・選択においては、「どれをつくりたいか」という問い(誘い)も同時に生まれてきて、有機合成化学者としての存在の意味を本研究で強く感じました。複雑さが増す創薬の現場において、本研究が研究者の皆様の参考になることを期待しております。
◆株式会社理論創薬研究所 代表取締役 吉森 篤史(博士)
生成AI技術とSBDDを組み合わせることで、効率的にリード化合物のデザインができることを確認することができました。今後も、最先端の生成AI技術とこれまでに蓄積されたin silico創薬技術を活用することで、さらなる創薬の効率化に挑戦したいと考えています。
◆株式会社インテージヘルスケア V&A部 創薬支援グループ 村上 竜太
私たちは創薬研究の現場において、実践的であることを最重要視し、AI創薬の技術開発とサービス展開を協力会社とともに行ってきました。AI創薬で実践的であるということは、有機合成や構造解析などの近接領域といかに連携できるか、ということでもあります。今回の共同研究の成果は、実践的なAI創薬の事例を示すものとして、国内外の医薬品開発に広く貢献できるものと思っております。
【謝辞】
本研究は、日本医療研究開発機構(AMED)生命科学・創薬研究支援基盤事業(BINDS;JP23ama121044)、科学研究費基盤研究(21H02426)、JST CREST(JPMJCR22E4)公益財団法人第一三共生命科学研究振興財団の支援のもとで行われたものです。
【用語説明】
注1)「Deep Quartet」:
株式会社インテージヘルスケアと株式会社理論創薬研究所、株式会社アフィニティサイエンスが 3 社連携で開発・提供するAI 創薬プラットフォーム。「Deep Quartet」は、深層強化学習の技術である(1)Deep reinforcement learning、ファーマコフォアモデルを用いるソフトウェア(2)LigandScout、網羅的なターゲット予測を可能とする機械学習ベースの技術(3)CzeekS を組み合わせた一連のフローであり、ここに (4)メディシナルケミスト(有機合成化学者)の知見を加えることで、Quartet(四重奏)による AI 創薬プラットフォームを実現している。
注2)化学合成:
化学反応を用いて目的とする分子をつくること。本研究では目的とする分子の基本骨格が炭素で構成されている有機化合物であり、有機反応を用いて分子を構築している。
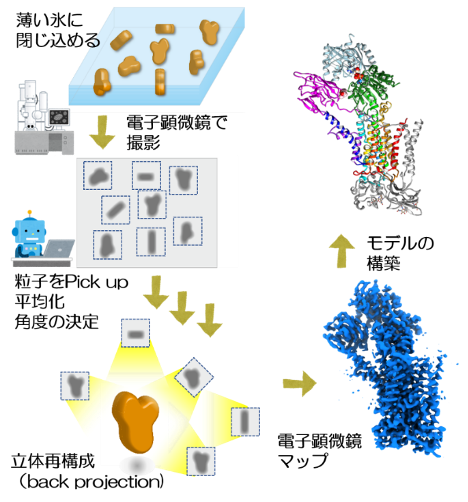
注3)クライオ電子顕微鏡:
クライオ電子顕微鏡とは、タンパク質などの生体試料を液体窒素温度(-196℃)で観察できる特殊な電子顕微鏡を指す(クライオ=低温という意味)。このクライオ電子顕微鏡を使った単粒子解析(Cryo-EM)では、まず精製したタンパク質を薄い氷の中に閉じ込めて画像を撮影する。画像には、いろいろな方向を向いたタンパク質が映っているが、一つ一つの粒子はノイズが多く、はっきりとした形がわからない。そこで、コンピューター上で同じ方向を向いている粒子を重ね合わせ、様々な角度から逆投影することで、数十万粒子の画像から立体構造を構築する。この方法によって高い解像度でタンパク質の立体構造が得られる。この方法の開発に貢献した3名の研究者が、2017年にノーベル化学賞を受賞した。COVID-19のスパイクタンパクをはじめ、様々なタンパク質の構造に基づいた創薬研究にも世界的に広く利用されている。
注4)官能基:
有機化合物の性質を特徴づける、有機化合物中の原子や原子団のこと。ヒドロキシ基(-OH)、アミノ基(-NH2)、カルボニル基(C=O)などがある。有機化合物の基本骨格は炭素原子と水素原子で構成されるが、それ以外の原子(酸素原子、窒素原子、塩素原子など)が有機化合物の骨格に組み込まれることで、分子の性質が変化する。すなわち、どのような骨格をつくり、そこにどのような官能基を配置するかが、医薬品を含む機能性分子創生の鍵となる
|
【研究者連絡先】 |
- 現在の記事
- 人工知能で胃酸抑制剤の候補をデザイン ~AI×化学×電子顕微鏡で創薬に新たなフロー~(プレスリリース)
 cespi.nagoya-u.ac.jp
cespi.nagoya-u.ac.jp