SPring-8 NEWS 28号(2006.9月号)
 アメフラシはこんな生き物
|
研究成果・トピックス
~アメフラシ体内物質の制がん効果を追って~
海洋生物アメフラシとは
海辺に生きる軟体動物アメフラシを知っていますか。貝類と同じ仲間に属しながら、背中に負っているはずの貝殻がすっかり退化してしまったアメフラシは、茶色っぽい紫色をした長さ15cmほどの生物です。浅瀬に住んで海藻を食べるので、磯の潮溜まりをゆっくり移動する姿にときどきお目にかかります。
こんな名前がついたのは、雨が降っているときに磯辺によく集まるからとも、体を刺激すると紫色の体液を出して雨雲のような煙幕をはるからとも言われます。いずれにしても、美しくもなく食用にするわけでもない、あまり目立たない生き物なのですが、意外にもアメフラシは科学者たちの関心を集めてきました。
その理由のひとつは、神経について研究する科学者たちが、アメフラシの巨大神経細胞(といっても直径1mmほどですが)を実験の材料として愛用してきたため。そしてもうひとつは、制がん剤になりそうな物質がアメフラシの体内から見つかっているからです。今回紹介するのはこの制がん剤候補物質についてのホットな研究成果です。
アメフラシ由来の制がん剤候補物質がどんな構造をもち、どんなしくみでがん細胞を働かなくするのか、その謎に挑んでいるのが(独)理化学研究所播磨研究所に所属する平田邦生研究員(当時(財)高輝度光化学研究センター協力研究員)や(財)高輝度光化学研究センター利用研究促進部門高田昌樹部門長たちです。謎解きは大型放射光施設SPring-8を利用して行われています。
制がん剤候補はこんな構造
自然界の物質からがんに効く薬を見つけだそうという研究は昔からさかんに行われてきました。天然物から見つかって、がん治療に使われている薬は多数あります。たとえばマイトマイシンCは微生物から、ビンブラスチンはツルニチニチソウという植物から見つかりました。
海洋生物から制がん剤を見つけようという研究もさかんです。アメフラシから「アプリロニンA」という物質をはじめて見つけ出し、これに強い制がん作用があることを最初に確認したのは、名古屋大学山田靜之名誉教授でした。
山田名誉教授は三重の海岸に生息するアメフラシを何十kbも採ってきてそれをすりつぶし、微量のアプリロニンAを取り出しました。がん細胞を仕込んだネズミにこの物質を与えると、与えないネズミに比べて長く生きることを実験で確かめたのです。アプリロニンAはがん細胞に働いて、その働きを抑える力をもっていることが明らかになりました。今ではその制がん効果は、強力な制がん剤として使われているマイトマイシンCを上回ることがわかっています。
山田名誉教授のお弟子さんだった筑波大学木越英夫教授は化学の専門家で、 NMR(核磁気共鳴)という方法を用いてこの物質の立体的な構造を明らかにし、またこの物質の合成にも成功しています。
アプリロニンAの構造を図で見てみましょう(図1)。マクロラクトン環とよばれる炭素の骨格をもった大きな環状構造に複雑に折れ曲がった尾がついている様子が見て取れます。それでは、いったいどの部分が制がん作用を発揮するのでしょうか。逆に言えばこの物質はがん細胞にとってなぜ毒として働くのでしょう。
山田名誉教授のグループはこの研究によって、アプリロニンAが生体内のアクチンに働くことを解明しました。アクチンはタンパク質の一種で、真核生物が細胞内に一番多くもっているタンパク質です。細胞膜の内側に網目状に広がって細胞の形をつくり、また細胞の運動を司る基本的なタンパク質として知られています。
アクチンは多数の分子が重合*してフィラメント状になったり、またひとつずつの分子(単量体)に戻ったりしていますが、アプリロニンAがアクチンに取り付くと、バラバラの単量体のままになって、フィラメントには戻らなくなることが判明しました。アクチンの働きにとっては致命的な事態です。細胞骨格が保てず細胞が破綻してしまいます。
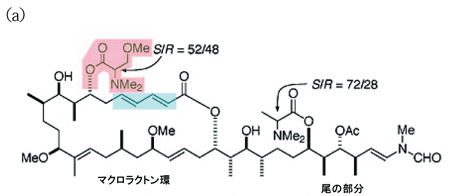 図1.左半分は主にマクロラクトン環で、右半分は主に炭素鎖で構成されている尾の部分。
図1.左半分は主にマクロラクトン環で、右半分は主に炭素鎖で構成されている尾の部分。図中、ピンク色でトリメチルセリンを、水色でジエンを取り囲んでいる。原子間を結ぶ線が太い部分は紙面から手前側、点線部分は紙面より向こう側に結合が出ていることを表現している(立体配置)。
S/Rは矢印で示した炭素原子を中心に正四面体構造が反転(立体配置が反転する)している状態を比率で示している。
Meはメチル基(CH3)を示している。
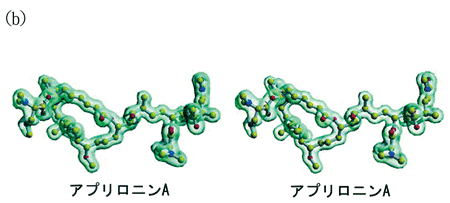 ★左図と右図を立体視(平行法)してご覧下さい。(a)の構造式に対応させてみると構造がよくわかる。黄:炭素 赤:酸素 青:窒素
★左図と右図を立体視(平行法)してご覧下さい。(a)の構造式に対応させてみると構造がよくわかる。黄:炭素 赤:酸素 青:窒素 結合体をSPring-8で解析
さて、このあたりからいよいよ平田研究員たちの登場です。平田研究員はタンパク質の構造を調べる専門家です。学生時代からSPring-8にやってきて、様々なタンパク質の構造解析に取り組んできました。
X線でタンパク質の構造を調べるにはタンパク質を結晶にしておかなくてはなりません。アクチンの場合、結晶にするには重合体(フィラメント)では不可能です。しかし、アクチンは通常なら重合してフィラメント状になってしまうので、単量体のまま調べるという条件がなかなか整いません。ところが、アプリロニンAはアクチンと結合するとアクチンを単量体に分解し、それぞれの単量体と1対1で結びつくので、結合体のままうまく結晶にすることができます。平田研究員は「無色透明の六角柱の結晶がすぐにできました」とうれしそうに話します。 150×100×50ミクロンという小さい柱状結晶でした。
さらに、朝できたアクチン-アプリロニンA結合体の良質な結晶は、その日のうちにタンパク質構造解析用のビームラインBL38B1で測定し、 0.145ナノメーターという高い解像度で構造解析を行うことができたのです。すでにわかっていたアクチンの構造を差し引くかたちで、アプリロニンAの構造が判明しました。また、どんな具合にアクチンと結合しているのかも見えてきました(図2)。
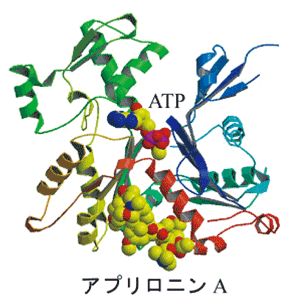
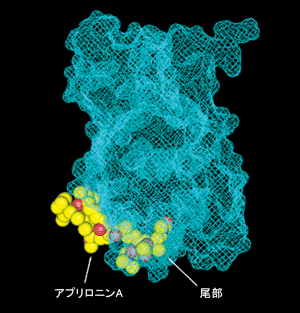 図2.
図2. (a).アクチン-アプリロニンA複合体構造の全体図
アクチンはリボン図、アプリロニンAとATP(アデノシン三リン酸)はCPKモデル(球体のモデル)で表示してある(黄色:炭素、赤:酸素、青:窒素)。
アプリロニンAは疎水的なアミノ酸で構成されている「疎水性クレフト(溝)」に結合していることがわかった。
アクチン自体には大きな構造変化は無かった。
(b).(a)図から90度回転させて横から見た図(回転軸は上下方向)
アクチンは水色のアミ目で表されており、アプリロニンAが尾を差し込んで結合している様子が見える。
脱重合*作用と制がん作用
アプリロニンAとアクチンはどのように結合しているのでしょうか。アプリロニンAが環状部分と尾から成り立っていることは先に述べました。結合体の構造解析から見えてきたのは次のような事実です。
アクチンが重合してフィラメント状になるときにアクチン分子どうしが結合する部分として知られている溝に、アプリロニンAは尾を差し込む形で結合しています。このためアプリロニンAに邪魔されてアクチンどうしが重合できなくなると考えられます。
このことは、以前に木越教授のグループがアプリロニンAの尾の部分を取り除いた構造の分子を合成し、この化合物ではアクチンをフィラメント状に重合させない(脱重合)効果が失われていることを確認していた事実とぴったり符合します。
一方、フィラメント状のアクチンを単量体に脱重合する化合物がすべてがん細胞に対する毒性を発揮するわけではないこともわかってきました。これは制がん活性に必要な特性ではありますが、それだけでは十分ではないのです。
平田研究員たちは、最近、細胞のアポトーシス(自発的な死)と脱重合の関係に注目するようになりました。アクチンのフィラメントを脱重合させる物質をがん細胞に加えると、この細胞にアポトーシスが起こることが報告されているからです。
また、アプリロニンAの環状の部分から突き出したトリメチルセリンと呼ばれる部分(図1(a)のピンクの部分)が、がん細胞に対して毒性を発揮することが知られています。「この部分がアポトーシスの信号になっているのかもしれません」と、平田研究員は制がん活性のメカニズムについて考えを巡らせています。
「まだ、決定的なことはわかりません。さらに生化学の専門家のサポートもほしいところです」と平田研究員。がん細胞を壊す新しいメカニズムの解明と、興味ある制がん剤が生まれる可能性をもつこの研究が、これからどんな展開を見せるのか、大いに注目したいものです。
取材・文:サイテック・コミュニケーションズ
用語解説
●重合・脱重合
重合とは簡単な構造をもつ分子化合物が二つ以上結合して高分子を生成する。この際に結合された化合物が重合体(ポリマー)と呼ばれ、元の分子化合物は単量体(モノマー)と呼ばれる。
脱重合とは重合体から単量体に分解していく反応。
この記事は、(独)理化学研究所播磨研究所 放射光科学総合研究センター 研究技術開発室 平田邦生氏(成果発表当時、(財)高輝度光科学研究センター 協力研究員)にインタビューをして構成しました。
行事報告
SPring-8 夏の学校

今年で6回目を迎えたSPring-8夏の学校。今回は(財)高輝度光科学研究センター、兵庫県立大学大学院/物質理学研究科・生命理学研究科、兵庫県立大学高度産業科学技術研究所の共催で7月7日~10日に開催されました。年々参加希望者数も増え、今年は50名を超える応募があり、選考の結果36名の学生が4日間のカリキュラムに参加しました。初日は基礎講座(4科目)、2日目と3日目は実験ステーションを使った実習2科目、最終日には応用講座(4科目)の講義で全てのカリキュラムが終了しました。受講希望者数が最も多かったX線イメージング実習では、受講者を2チームに分けて、相手チームに分からないよう、サンプルを作製して、ゲーム形式でサンプルを観察しました。最初は緊張した面持ちだった受講者たちも、次第に打ち解けていきました。学校や専門分野を超えた交流は、彼らにとって貴重な体験だったのではないでしょうか。参加者の中から次世代の放射光分野を担う研究者が育ってくれることを期待しています。
3極ワークショップについて

6月20日(火)、21日(水)に、10回目になる3極ワークショップがESRF(欧州放射光施設、グルノーブル、フランス)で開催されました。3極ワークショップは、世界の放射光施設のビッグ・スリー、すなわちSPring-8(西播磨、日本)、APS(アルゴンヌ、米国)、そして今回主催のESRF、のスタッフの代表が1年~1年半に一度集まり、3大放射光施設の現状、将来展望そして固有の問題などに関して、意見交換を行う会議です。
ワークショップの会期中、密度の濃い議論と人的交流が行われました。取り上げられた議題は、「トップアップ運転」、「マイクロ・ナノX線集光技術」など、現在、SPring-8などで話題になっているものです。また、今回初めて、「10年という長い時間をかけて進行する、放射光などによる機器損傷」が議題になりました。SPring-8も稼動して約10年、次の10年に備えたリフレッシュの重要性を感じた会議でした。
実施した行事
● 6月23日 放射光利用ナノテク最前線2006(東京)
SPring-8では立命館大学SRセンターとともに、2002年度から「文部科学省ナノテクノロジー総合支援プロジェクト」を実施しています。「放射光利用ナノテク最前線2006」は2005年度に支援を実施した研究成果を紹介する報告会で、放射光を利用した最先端のナノテクノロジー研究が多数報告されました。
● 8月5日 青少年のための科学の祭典(兵庫県立先端科学技術支援センター)
● 8月9日~11日 高校生のためのサイエンスサマーキャンプ(SPring-8など)
兵庫県下の高校生が体験実習や研究者との交流を通して科学技術分野への理解を深めるサマーキャンプ。今年度で9回目の開催です。
今後の行事予定
● 9月16日 のじぎく兵庫国体炬火リレー出発式 ~未来に向かう科学の火~
9月末に開催される「のじぎく兵庫国体」では、10カ所で採火された炬火が開会式に向けて県下をリレーで回ります。西播磨地域では、SPring-8の放射光から採られた「未来に向かう科学の火」を使い、構内で出発式が行われます。
● 11月1日~12日 科学体験館サイエンスサテライト ~SPring-8特別展~(扇町キッズパークビル・大阪)
● 10月15日~19日 第5回低エネルギー電子顕微鏡および光電子顕微鏡国際会議(LEEM/PEEM-V)
SPring-8,応用物理学会の主催、姫路市の共催でイーグレひめじにおいて開催。新しい顕微鏡である、表記顕微鏡を用いた研究に関する議論をする予定です。
SPring-8 Flash
X線自由電子レーザー(XFEL)試験加速器からレーザー光の発振に成功
(独)理化学研究所と(財)高輝度光科学研究センターは共同で、X線自由電子レーザー(XFEL)の試験加速器を完成させ、波長49ナノメートル、最大出力110キロワットの自由電子レーザーの発振に成功しました。現在、加速エネルギー8ギガ電子ボルト、全長約800メートルのXFEL発振器建設が始まっており、2010年の完成、さらに世界初のX線レーザーの実現を目指して、鋭意研究開発が行われています。XFELを利用すれば、例えば薬のターゲットであるタンパク質の中でも解析が難しい膜タンパク質の構造解析やナノテクノロジーにおける新機能性材料の創成等に威力を発揮し、幅広い分野で革新的なサイエンスが花開くことになるでしょう。
 |
 |
|
つめかけた報道陣に説明する
新竹グループディレクター |
発振したレーザー光の明るさを
確認する矢橋研究員 |
第4回産学官連携推進功労者表彰:「日本学術会議会長賞」を日本原子力研究開発機構 西畑保雄氏が受賞
この賞は、大学、企業等における産学官連携活動において大きな成果を収め、また先導的な取り組みを行う等、産学官連携の推進に多大な貢献をした優れた成功事例に対して与えられる賞で、平成15年度より始まり今回で第4回目です。このなかで日本学術会議会長賞は、学術の視点から特に顕著な功績又は功労があったと認められる者に与えられ、日本原子力研究開発機構の西畑保雄氏は、ダイハツ工業(株)の田中裕久氏とともに自動車排ガス浄化触媒の開発研究に対して受賞しました。この研究は、自動車排ガス環境の苛酷な使用条件下においても触媒機能が全く低下しないものの開発とその機構解明を行ったものであり、自動車排ガス浄化触媒として使われている貴金属のPt, Pd, Rhの使用量を従来の触媒に比べて70%~90%も低減することのできる画期的な触媒です。この触媒は現在、実際に200万台以上のガソリン車に搭載されその威力を発揮しています。
兵庫県立大学大学院生命理学研究科の吉川信也教授、村本和優助教授、伊藤恭子助手に文部科学大臣表彰
兵庫県立大学の吉川教授、村本助教授、伊藤助手が「チトクロム酸化酵素のX線結晶構造の研究」の業績で、平成18年度科学技術分野の文部科学大臣表彰科学技術賞(研究部門)を受賞されました。
我々は肺から酸素を取り入れ、摂取した食物を燃焼させてエネルギーを得ています。摂取した食物を直接燃焼させてしまっては、熱が出るばかりで、細胞が利用できる形のエネルギーは得られません。そこで、細胞の中のミトコンドリアという器官には、呼吸鎖電子伝達系というしくみがあり、効率良くエネルギー変換を行っています。吉川教授らの研究グループでは、その過程で働いているチトクロム酸化酵素(呼吸酵素)というタンパク質の構造研究を行いました。呼吸酵素は脂質膜の中に埋まっていて全く水に溶けないため、結晶を作ることがこれまで非常に困難でしたが、「ウシ心筋の呼吸酵素を膜から取り出し、それを水の中に安定に存在させる」方法を長い年月をかけて開発を行い、SPring-8を用いたX線結晶構造解析により、その立体構造を解明しました。この成果は、生命理学の中心課題であるだけでなく、今後は医薬品の開発にも重要な貢献をすると期待されています。