タンパク分子にひそむ究極のスイッチ機構 ~立体構造解明に成功~
科学技術振興事業団 ERATO プロトニックナノマシン
プロジェクト統括責任者
大阪大学大学院生命機能研究科教授
(財)高輝度光科学研究センター
放射光研究所客員主席研究員(非常勤)
難波 啓一
べん毛モーターは精巧なナノマシン
細菌が動き回る様子を紹介したビデオを見たことのある人は多いでしょう。そして、あんな微生物が、どのような仕かけで動いているか疑問に思う人も少なくないと思います。サルモネラ菌、大腸菌、ピロリ菌などは、数本のムチのようなしっぽ(べん毛)をもっています(4ページの写真参照)。このべん毛は、実はコイルバネのような形のらせん型スクリューで、細菌はこれを毎秒200〜400回も回転させ、1秒間に体長の20倍ほどの距離をらくらく移動します。実は、微生物の動きは究極の省エネ機関ともいえる器官によって制御され、そこには21 世紀を支えるナノテクノロジーのヒントがたくさんつまっているのです。細菌の運動器官であるべん毛が、回転モーター、軸受け、回転シャフトなど、人工の推進機関そっくりの機能とデザインをもつべん毛モーターによって高速回転しているというのは大きな驚きです。自然が長い試行錯誤の末に組み上げた精巧なナノマシン(分子機械)なのです。
べん毛繊維は直径20ナノメートル(nm、1nmは1mm の千分の1のそのまた千分の1)、長さ10数マイクロメートル(μm、1μm は1mmの千分の1)で、素繊維と呼ばれる11本の細長い繊維が円筒状の束になってできています(図1)。この素繊維を形づくるのがフラジェリンという分子量約5万のタンパク質分子で、今回、ついにその立体構造を突きとめることができました。
フラジェリン分子が全て同じ大きさと形であれば、直線状の繊維にしかならないはずです。ところが、周期長の異なる2種類の素繊維構造が、11本の中にある割合で同時に存在するため、べん毛全体としてゆるやかにねじれた左巻きらせん構造になるのです。また、べん毛モーターが急反転してべん毛繊維にねじれの力が加わると、何本かの素繊維では周期長が切り替わってらせんのねじれを右巻きに反転させます。これによって細菌は反対方向に運動を変えることができるのです。X線繊維回折法による精密な測定から、切り替わる前後の2種類の繊維構造がそれぞれ5.19nm と5.27nm の周期長をもち、わずか0.08nm という周期差がべん毛らせんの急反転に関わることがわかってきました。すなわち、素繊維は原子の大きさ(約0.1nm)の10分の1以下の精度で働く究極のスイッチ機構をもっているといえるのです。
極微小試料で分子構造を決定
立体構造を原子レベルで決めるためには、分子が整然とならんだ結晶試料が必要です。しかし、フラジェリン分子は重合して長い繊維状になりやすく、結晶にすることはできません。そこで、サルモネラ菌のべん毛からフラジェリン分子(分子量51,500)を取り出し、繊維構造の安定化する部位をほぼ全部切り取りました。こうして、繊維形成能力を失ったフラグメント(分子量約41,000。F41と略記)をかき集め、これをもとにして良質の結晶試料を作ることができました。でも、得られた結晶試料の大きさはせいぜい数μm、とても一般のX線装置にかけてデータ収集できるようなしろものではありませんでした。そこで、第3世代放射光源であるSPring-8の高輝度X線がその威力を発揮するわけです。この微小な結晶試料を凍結させ、理研ビームラインBL45XUにおいて多波長異常分散法と呼ばれる手法により、高精度のX線回折データを得ることに成功しました。
構造決定されたF41は3 つの領域D1、D2、D3からできあがっています(表紙参照)。D1領域は3本の長いアルファヘリックスと1本のベータヘアピンで構成され、D2領域とD3領域のほとんどはベータストランド注1でできています。結晶構造のある方向に沿ったフラジェリン分子の配列の繰り返し周期は5.19nm で、素繊維の繰り返し周期の1つと同じであることがわかりました(図1右と図2左)。そこで、その方向に沿ったフラジェリン分子の配列を取り出し、電子顕微鏡観察などで得られたべん毛繊維の低分解能電子密度マップと照らし合わせたところ、分子全体の大まかな形状や分子の並びが見事に一致したのです。べん毛繊維では素繊維11本が同じ向きに並んで束になっていますが、結晶中では素繊維がその向きを互い違いにしてシートを作り、このシートが積み重なって結晶になっていることもわかりました。
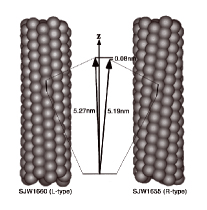
図1:11本の素繊維から成るべん毛繊維。
素繊維の周期長は約5.2nmですが、右巻きらせんと左巻きらせんではその長さが0.08nmだけ異なります。つぶつぶはフラジェリン分子を表します。
コンピュータシミュレーションでスイッチ作用を再現
次に、素繊維のスイッチ機構を調べるため、構造決定されたフラジェリン分子に力を加え、その構造がどのように変化するかをコンピュータシミュレーションしました。このためには、フラジェリン分子3個からなるモデル素繊維を作り、一番上のフラジェリン分子を動かないように固定しました。そして、一番下のフラジェリン分子を0.01nmずつ下方に移動させながら中央の分子の構造変化をコンピュータ上でじっと観察しました。最初のうちしばらくは構造全体が徐々に伸びていきましたが、あるところで、D1領域にあって、フラジェリン分子同士が繊維軸方向に接触する部位(図2左の黒枠部分)のベータヘアピンが、わずかに、しかし急激に構造変化したのです(図2右)。このことは、異なる周期構造間を切り替わるスイッチが、このヘアピン部分に存在することを示しています。0.08nm という原子1個分(約0.1nm)以下の微小な変位を実現するスイッチ作用は、フラジェリン分子内のこの微小な構造変化によって起こっていたのです。
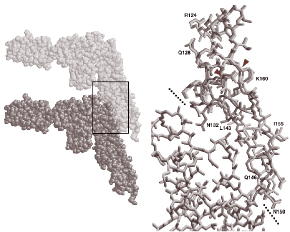
図2:スイッチ作用のコンピュータシミュレーション。
左図は素繊維軸に沿った二つのフラジェリン分子の接触状況を、全ての原子をつぶつぶで示してあります。右図は左図中の黒枠部分(二分子の接触部分)の拡大図で、全ての原子間結合を棒で表しました。二本の点線は二分子の境界位置を示すものです。下のフラジェリン分子を0.45nm(淡色)から0.47nm(濃色)移動させたとき、上のフラジェリン分子のベータヘアピン(二つの三角マークがその両端を示す)のみが急激な構造変化を見せ、ここにスイッチ作用があることを示しています。構造変化は、色違いの二つの構造が大きくずれていることからわかります。
生物はナノテクノロジーのヒントの宝庫
今回の成果は、タンパク質の柔軟な基本構造の中に、精巧な力学的スイッチをもつフラジェリン分子の立体構造を明らかにしたものです。このことは、フラジェリン分子のみが特別なタンパク質であることを示すものではありません。水素結合という弱い結合から成ることで生じる立体構造の柔軟性と、原子一つ一つを部品として組み上げることにより精巧な動作機構を併せもつというタンパク質の大きな特徴を実証しているのです。
ナノテクノロジーは、いろいろな原子を組み合わせ積み重ねて、ナノスケールの機能素子や複雑な機能をもつナノマシンの構築を目指す分野です。タンパク質はナノスケール、サブナノスケールで動作するナノマシンといえます。生命を支えるしくみの中には、私たちが未だ理解していない、あるいは想像をはるかに超える原理を含め、ナノテクノロジーのお手本になるものが豊富にひそんでいるのです。
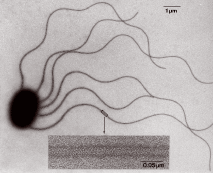 サルモネラ菌のべん毛の電子顕微鏡写真
サルモネラ菌のべん毛の電子顕微鏡写真●注1
タンパク質の立体構造を作るための基本的な構成要素で、2次構造と呼ばれる。アミノ酸は一列に結合してペプチド鎖を作る。これがらせん状に巻いて連なった構造をアルファヘリックス、直線的につながる平板型構造をベータストランドと呼ぶ。また、ベータストランドの折り返し構造をベータヘアピンと呼ぶ。折りたたまれたペプチド鎖間ではNH基とCO基が水素結合を作る。このため、これらの2次構造は安定かつ規則的な構造になる。