SPring-8とクライオ電子顕微鏡で解き明かした最強のイオンポンプの仕組み
SPring-8とクライオ電子顕微鏡で解き明かした最強のイオンポンプの仕組み
胃酸ができる仕組みを理解し、創薬に応用
100万倍の濃度に逆らって働く最強ポンプ
ご飯を食べることは、私たちの楽しみの一つです。口に入った食べ物は噛み砕かれ、口や胃や腸で分泌される消化酵素によって分解され、最終的には細胞が利用できるサイズまで小さくなります。これが消化と呼ばれる過程です。
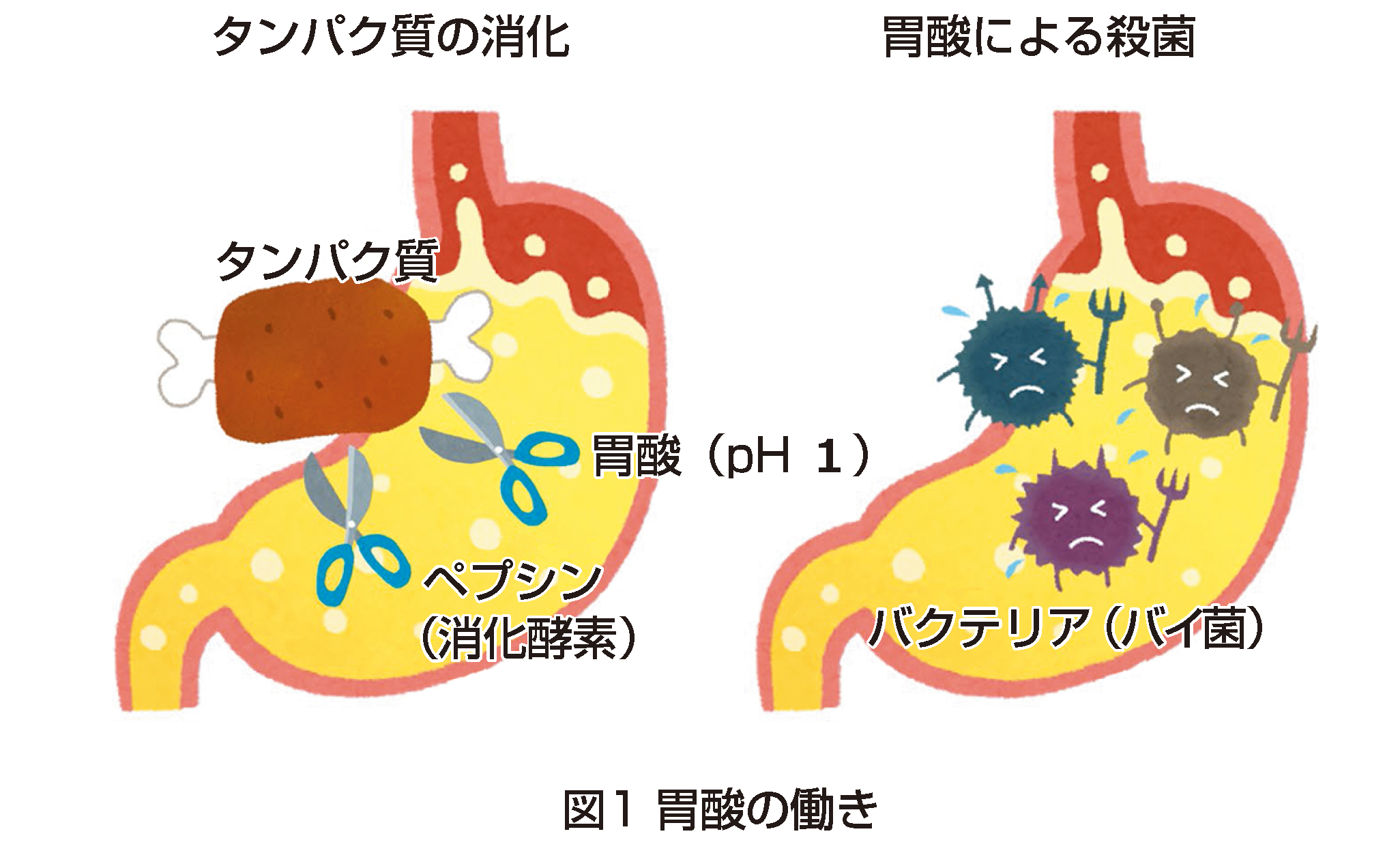
消化の過程の中で重要な働きを担っているのが胃酸です(図1)。胃酸は、pH 1の強力な酸で、タンパク質を分解されやすい構造に変えます。また、消化酵素ペプシンを活性化します。胃の中に入った食べ物についている細菌のほとんどは胃酸で死滅します。そのおかげで、胃の中に食べ物が3、4時間留まっても腐ることはありません。
この強力な酸を作り出しているのは、胃プロトンポンプと呼ばれる胃壁細胞の細胞膜に埋まったタンパク質です。名古屋大学の阿部一啓さんは、長年にわたって胃のプロトンポンプの働く仕組みを研究してきました。
「通常であれば、液体中の物質は、濃度の濃い方から薄い方へ移動します。自由に物質が移動できる空間では、時間が経つと液体の濃度は均一になります。しかし、生物は濃度に逆らって物質を偏らせる仕組みを持っています。そのひとつがイオンポンプです。細胞の外と中では液体中に存在するイオンの濃度が異なります。坂道から転がり落ちていくボールを坂の上に戻すように、イオンポンプは濃度に逆らってイオンを運んで、細胞膜の外と中のイオン濃度の偏りを一定に保ち、多様な生体反応に役立てています」
さまざまなポンプが存在する中で、なぜ、阿部さんは特に胃のプロトンポンプに注目しているのでしょうか。
「胃のプロトンポンプが最強のポンプだからです。酸性の強さはプロトン(水素イオン:H+)の濃度で決まります。胃の中のプロトンの濃度は他の体内の場所よりも100万倍も濃いのです。胃のプロトンポンプは100万倍という激しい濃度勾配に逆らって、胃の中へプロトンをせっせと運んでいます。いったいどうやってそんな力技を成し遂げているのか。この手で解明したいと思いました」
新薬が胃酸を抑制する仕組みを調べる
胃プロトンポンプの構造は、長い間、謎に包まれたままでした。阿部さんは学生の頃から胃プロトンポンプの構造を解き明かすために試行錯誤を重ねてきました。そして、2018年に世界で初めて、SPring-8を使って胃プロトンポンプの構造と働く仕組みを明らかにすることができました。
成功の秘訣は何だったのでしょうか。
「1つはヒト培養細胞を使った方法で、胃の純粋な試料を大量に得ることに成功したことです。もう1つは、胃プロトンポンプの阻害剤の研究を同時に進めていたことです。胃プロトンポンプ単独ではなく、阻害剤を結合させた状態で結晶を作ることで、安定した胃プロトンポンプの構造を得ることができました」
胃プロトンポンプの阻害剤は胃酸の出過ぎを抑えることができるため、有効な薬になります。なぜなら、胃酸は、自分の組織さえ傷つける諸刃の剣だからです。胃酸は胃以外の場所にあふれ出てしまうと、胸やけや喉の痛みを起こします。また、通常は粘液で守られている胃の内部も、体の調子が悪くて粘液が出なかったり胃酸が出過ぎたりした場合は、胃酸によってダメージを受けて胃痛や炎症が起こります。そのため、古くから臨床の現場では、胃酸を抑える薬が治療として使われてきました。
「これまでにさまざまなタイプの胃酸抑制剤が開発されてきましたが、私たちが注目しているのは、P-CABと呼ばれるグループの新しいタイプの胃プロトンポンプ阻害剤です。最初に開発された化合物SCH28080は、様々な制約から薬としては使えませんでしたが、その構造を基にいくつかの薬が作られました。日本では武田薬品工業からVonoprazanという阻害剤がタケキャブ®という商品名で、2016年から販売されています。P-CABは、これまでに使われていた薬よりも速やかに、かつ持続的に胃酸の分泌を抑える有用な薬ですが、どのような仕組みで効いているのかはわかっていませんでした」
阿部さんたちは、P-CABを胃プロトンポンプに結合させ、胃プロトンポンプの構造を調べると同時に、P-CABがポンプのどこに結合しているのかをSPring-8とクライオ電子顕微鏡を使って調べたのです。
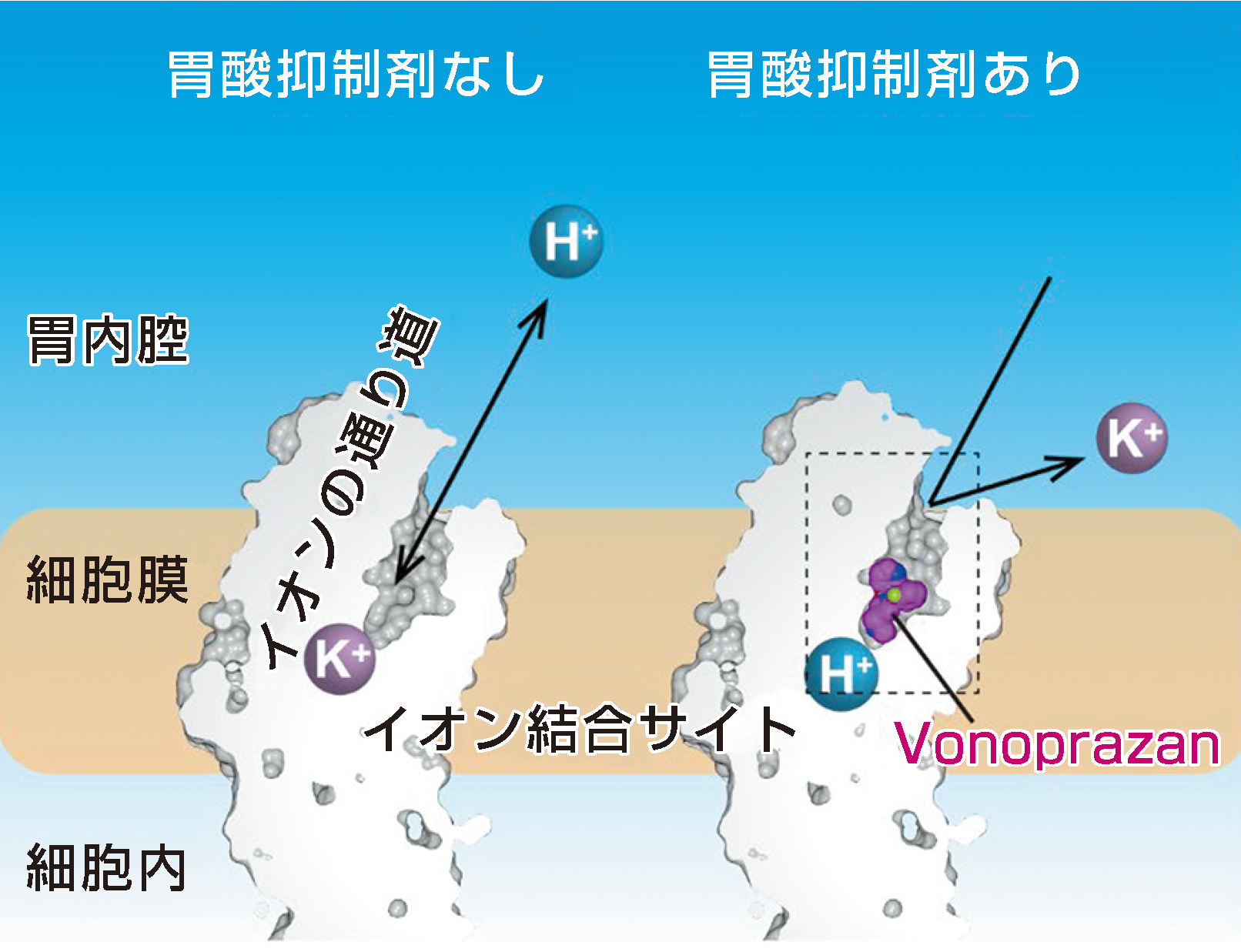
まず、P-CAB開発のもととなった化合物SCH28080と、Vonoprazanを結合させた胃プロトンポンプの結晶を作製しました。放射光をタンパク質結晶に当てると回折像が得られ、その回折像からタンパク質の構造を導き出すことができます。阿部さんたちは、SPring-8のタンパク質構造解析ビームライン(BL32XU、BL41XU)を利用して、胃プロトンポンプと阻害剤の複合体の回折データを取得しました。その結果、胃プロトンポンプの構造が明らかになり、P-CABグループに属する阻害剤は、イオンの通り道にはまり込むように結合していることがわかりました(図2)。
「胃プロトンポンプが、カリウムイオンとプロトンを交換する形でプロトンを胃の中に送り込むことはわかっていました。今回の結果で、P-CABがその通り道をふさぎ、プロトンを送り込むのを邪魔していることがわかったのです」
これらの結果は2018年に英国科学誌『Nature』に掲載されました。
図2 胃プロトンポンプの構造とP-CAB Vonoprazanの作用する場所の模式図
構造が分かれば薬の改良が容易になる
阿部さんたちの研究グループはさらにP-CABグループの他の阻害剤についても調べ、4つの阻害剤の結合の様子を詳細に明らかにし、2022年に米国化学会雑誌『Journal of Medicinal Chemistry』に発表しました。
2022年の論文の研究では、X線結晶構造解析だけでなく、SPring-8に設置されているクライオ電子顕微鏡も利用しました。クライオ電子顕微鏡による単粒子解析は、タンパク質を薄い氷に閉じ込めて画像を撮影し、コンピュータ上で大量のデータを解析する方法です。この手法を使うことで、結晶になりにくい胃プロトンポンプと阻害剤の複合体構造も解き明かすことができました」
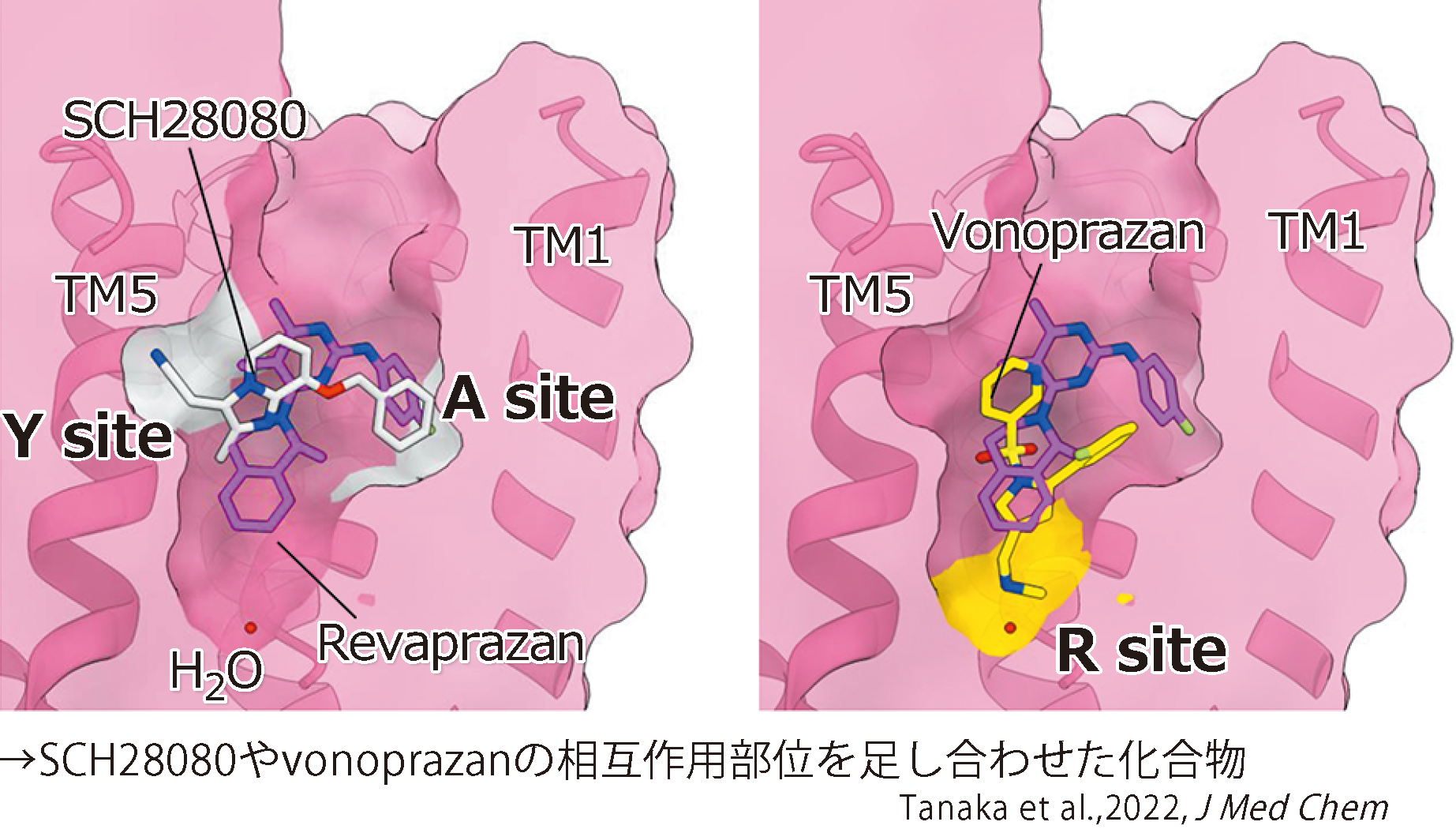
P-CABグループの阻害剤はすべて胃プロトンポンプのイオンの通り道をふさいでいましたが、詳細に見ていくと、そのふさぎ方に違いがありました。図3の左側の白い形はSCH28080の結合状態を表しています。通り道に対して横長にふさいでいます。一方、右側の黄色で示しているVonoprazanは、縦に長くなった形で通り道をふさいでいます。さらに、両方の図に重ねて赤紫色で示したRevaprazanは、SCH28080の作用する場所と、Vonoparazanが作用する場所の両方を弱くカバーしています。
「このように構造が詳細に見えてくると、より良い薬剤を設計していくことができます。たとえば、RevaprazanがSCH28080の作用場所とVonoparazanの作用場所の両方をカバーしていることに注目して、さらに強く両方に作用するような構造の化合物を作れば、もっと効果は高くなるかもしれません。また、副作用が出た場合も、どの部分の構造が原因なのかを調べて、そこだけを変えて、薬としての作用はそのまま残すというアレンジも可能になります」
SPring-8を使った構造解析はこれからの創薬の強力な武器になると阿部さんは確信しています。またSPring-8の放射光による高輝度X線だからこそ、短時間で解析をすることができ、膜の中にある壊れやすいタンパク質でもここまで詳細に解析ができたのです。
「2019年からBL45XUを始めとしてタンパク質結晶の自動測定環境が整備され、利用できるようになっていたことは、非常に助かりました。コロナ禍でも実験を止めることなく進められたからです。また、クライオ電顕による構造解析の手ごたえもつかみました。構造解析の専門家が集まっているSPring-8にクライオ電顕が設置されていることは、情報交換や技術の発展のためにも、大きな利点だと思います」
現在阿部さんは、研究結果をもとに、より効果の高い薬剤を開発中です。
「まだ論文で発表していないので詳細は話せませんが、プロジェクトは順調に進んでいます。胃プロトンポンプの働く仕組みを知りたいという想いが私の研究のもともとのモチベーションですが、研究成果が創薬につながり、苦しんでいる患者さんを助けることができたら嬉しいですね」
図3 SCH28080、Vonoprazan、Revaprazanの作用部位

阿部さんが「イオンポンプ」や「酵素」のような、構造を変化させて働くタンパク質に興味をもったのは、大学生のときでした。
「濃度に逆らって物質を輸送するポンプの話を詳しく教えてくれたのが、大学生のときに所属した研究室の谷口和弥先生でした。谷口先生は自身の師匠の言葉を引用して、『酵素は君と話したがっているのに、なぜ耳を閉じるんだ?』と言っていました。当時、私が取り組んでいたのは、酵素の反応を数値的に見る生化学という学問だったので、一生懸命、酵素の声に耳を傾けていました」
その後、声を聞くだけでは満足できなくなった阿部さんは、構造生物学に取り組み、タンパク質を「見る」ようになりました。今では、構造の一部を変えて反応の変化を確かめたり、阻害剤を作って口をふさいでみたりと「ずいぶん乱暴なこともしていますが」と笑います。科学技術の発達によって、研究者とタンパク質とのコミュニケーションの形は変わっていくのです。
趣味は研究だという阿部さんのささやかな楽しみは、出張や旅行のときに、その地元の地ビール屋をめぐることだそうです。
「先日、仕事でカナダとアメリカを回ってきました。向こうには小さな地ビール屋がたくさんあるんです。業務を終えた後には、そういうお店で地ビールを飲んで仕事の英気を養います」

文:チーム・パスカル 寒竹 泉美
この記事は、名古屋大学 細胞生理学研究センター 准教授 阿部一啓さんにインタビューして構成しました。