SPring-8が明かす ホタルが発光するしくみ
ホタルはなぜ光る

提供:東京ゲンジボタル研究所 古河義仁
夏の夜、ホタルのオスとメスが黄緑色の光を明滅させてたがいにその存在を知らせ合うさまは、風情ある季節の風物詩として、昔から日本人にたいへん愛されてきました。
なぜ、またどんなしくみでホタルが光るのか。科学者たちも長い間このテーマに魅了され続けてきたのです。
ホタルに代表される昆虫の発光現象が科学の目で解明されるようになったのは、19世紀終わり頃のことでした。すでに「ルシフェリン*」、「ルシフェラーゼ*」が文献に登場し、発光が酵素反応によって生じることが知られるようになっていました。
しかし、この酵素反応の詳しい解明が進み出したのは20世紀も半ばになってからのことです。
多くの研究者の手で少しずつ解明された発光のしくみは、およそ次のようなものでした(図1)。
発光反応の基質であるルシフェリンが酵素であるルシフェラーゼの触媒作用によって、生物の体のなかに広く存在するATP(アデノシン-三リン酸)と反応します。生じた中間体がさらに酸素と反応し、発光体であるオキシルシフェリンが生成します。
オキシルシフェリンはエネルギーの高い状態にあり、安定した状態になるためにエネルギーを光として放出します。
1996年には、アメリカ産ホタルから採取したルシフェラーゼの結晶構造が明らかにされました。
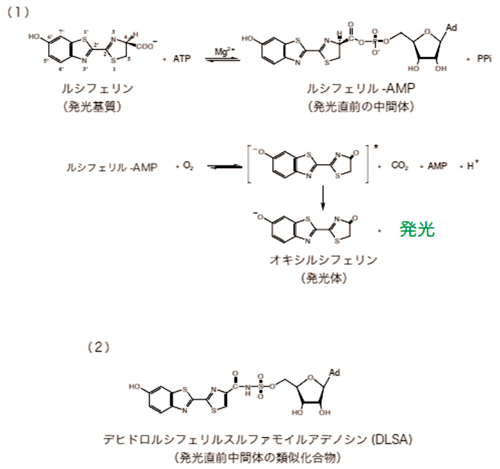
図1. (1)ルシフェラーゼによる発光反応メカニズム (2)発光直前中間体の類似化合物DLSA
発光色の変化のなぞ
この少し前に、京都大学大学院薬学研究科((独)理化学研究所播磨研究所兼任)の加藤博章教授の研究グループが、ホタルの発光のしくみの解明に本格的に取り組むようになりました。ルシフェラーゼの結晶構造が判明しても、発光のしくみがすみずみまで明らかになるにはまだ程遠い状態だったのです。
一方、80年代から遺伝子を操作することができるようになり、研究は大きく動きだしていました。アメリカ産ホタルや日本産のゲンジボタルからルシフェラーゼの遺伝子がとられ、大腸菌にこの遺伝子を組み込んでルシフェラーゼを大量につくらせることができるようになったのです。
また遺伝子の変異をつくり、ルシフェラーゼの構成部品であるアミノ酸をひとつだけ別の種類のものに置き換えたものをつくらせることもできるようになりました。アミノ酸がひとつ換わったルシフェラーゼでは、光の色が変化するのです。
たとえば、286番目にあるアミノ酸のセリンをアスパラギン酸に置き換えてみましょう。すると、黄緑だった発光色は赤に変わります。
かねて、反応溶液を酸性にしておくと、発光色が黄緑色から赤に劇的に変化することが知られていました。色の変化も多くの研究者が注目してきた不思議な現象です。
こうした研究成果を踏まえて、加藤教授のグループでは、発光のしくみを明かすには、反応している基質と酵素の結合した複合体の立体的な構造を詳しく調べる必要があると考えました。
構造を時間で追う
「刻一刻と変わる酵素反応の様子を追いかけよう」
そのためには、発光したあとの反応物だけではなく、そのすぐ前の段階の中間体の構造を調べることが必要です。京都大学化学研究所の平竹助教授や坂田教授の協力によって、不安定な反応中間体の一部の構造を変えた安定な物質を合成し、これを利用して、研究を進めることにしました。加藤教授たちのこの戦略を支えたのは、大型放射光施設(SPring-8)の理研構造生物学ビームラインI(BL45XU)とII(BL44B2)でした。
SPring-8によるX線解析では、0.13nm (1nm:ナノメートルは10億分の1メートル)というきわめて高い分解能で物質の構造を見極めることができます。発光のしくみを解明するために、加藤教授たちは「速度論的結晶学」を柱として取り組むことにしました。これは、結晶構造を時間とともに追跡し、反応機構を明らかにしようという手法です。原子・分子のレベルで物質の構造の変化を連続写真として撮影していく方法といってもよいでしょう。
加藤教授たちは、反応が始まる前、発光の直前、そして発光した後のルシフェラーゼの立体構造を比較してみました。すると、発光直前の段階で、288番目のアミノ酸であるイソロイシンが、発光体であるオキシルシフェリンのほうに大きく張り出していることがわかりました。この構造の違いに着目したのは中津 亨助教授です(図2参照)。
「ルシフェラーゼの288番目のイソロイシンが何かの働きをしている!」
そこで、今度は
1)野生のゲンジボタルのルシフェラーゼ
2)286番目のアミノ酸をセリンからアスパラギンに変異させた赤く発光するルシフェラーゼの
2種類のルシフェラーゼとで時間を追って構造の変化を調べてみました。
すると、変異体のルシフェラーゼでは、288番目のイソロイシンが発光直前に大きく張り出す現象は認められませんでした。
「野生型では、イソロイシン288がオキシルシフェリンの環状の部分を手で包み込むようにつかまえていますが、286変異型では指先で触れている程度で、オキシルシフェリンが動ける自由度があったのです」と、加藤教授は立体構造の動画を示します。
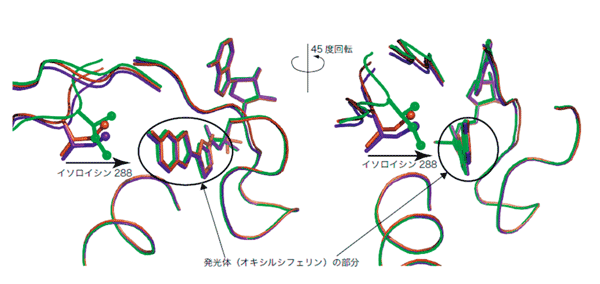
図2. 3つの反応段階のルシフェラーゼの立体構造の重ね合わせ図
左図の向きを45度方向変えると右図になる。反応が始まる前(茶色)、(2)発光の直前(黄緑色)、(3)発光した後(紫色)を比較すると、288番目のイソロイシン残基が発光体であるオキシルシフェリンの方に大きく張り出している。
発光機構が判明した
野生型では黄緑色に光るのに、286番目のセリンをアスパラギンに変えた変異型では赤く光る理由も、ここからわかってきました。
発光前のエネルギーの高い状態から安定な状態に変化するとき、その差が大きいと放出するエネルギーが大きく、発光は波長の短い黄緑色になります。しかし、変異型ではオキシルシフェリンが動く自由度があるために、エネルギーの一部が光ではなく熱(振動)として無駄使いされる結果、発光色は波長の長い赤色になるのです。
加藤グループはこの考えを裏付けるため、さらに実験を重ねました。
遺伝子改変によって、288イソロイシンからメチル基を外して小さくしたバリンをもつルシフェラーゼ、さらにもうふたつメチル基を外したアラニンをもつ変異体のルシフェラーゼをつくりました。イソロイシンより小ぶりな構造をもつこれらの酵素は、オキシルシフェリンをしっかり包み込むことができないので、放出エネルギー差は小さくなり、発光色は赤味がかると予想したのです。
結果はそのとおりでした。バリン型ではオレンジ色に、アラニン型では赤く発光することを確認できました(図3)。
ホタルをはじめとする光る昆虫たちは、発光酵素のアミノ酸配列のわずかな違いで発光色の違いを演出しているのです。
ホタルの発光は効率がきわめて高く(エネルギーが光に変換される効率は88%に達します)、蛍光灯でようやく20%であるのに比べても抜群のエネルギー効率のよさが魅力的です。
この発光系を利用した基礎研究のほかダイオキシンの測定や食品衛生検査などの各種分析の手法が開発されているほか、癌の転移のメカニズムをルシフェラーゼを導入したガン細胞の発光現象を利用してリアルタイムで観察する研究も進んでいます。
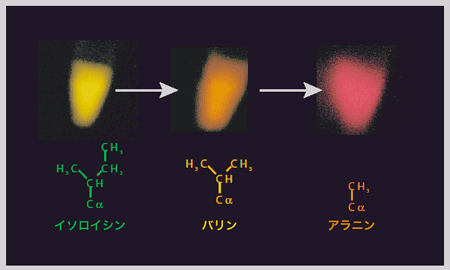
図3. 288番目のイソロイシン残基の大きさの変化による発光色の変化
残基の大きさが小さくなるにつれ、黄緑色、橙色、赤色に変化した。
取材・文:サイテック・コミュニケーションズ
用語解説
●ルシフェリン
ルシフェラーゼによって酸化されて発光する様々な基質の総称。
●ルシフェラーゼ
発光バクテリアやホタルなどの生物発光において、発光物質が光を放つ化学反応を触媒する作用を持つ酵素の総称。発光酵素とも呼ばれる。
この記事は、京都大学大学院薬学研究科教授の加藤 博章氏(成果発表当時、(独)理化学研究所播磨研究所兼任)、助教授の中津亨氏(同)にインタビューをして構成しました。