パーキンソン病根本治療への鍵、脳内レビー小体の構造解析に成功
研究成果 · トピックス
パーキンソン病根本治療への鍵、脳内レビー小体の構造解析に成功
レビー小体の謎
手が震えたり動作がぎこちなくなったりするパーキンソン病は、60歳以上では100人に約1人という高い割合で発症する脳の難病で、いまだに根本的な治療法がありません。
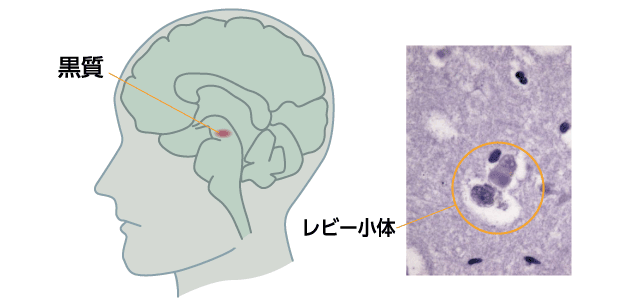
脳の黒質と呼ばれる場所で、神経伝達物質ドーパミンを分泌して運動をつかさどる線条体という場所へ情報を伝える神経細胞の細胞死が起き、ドーパミンが不足することでパーキンソン病は発症します(図1)。症状はドーパミンを補う薬により改善されますが、やがて薬は効きにくくなり、神経細胞の細胞死がさらに進行することで症状は悪化していきます。
神経細胞の細胞死を食い止め、さらには発症前に細胞死を防ぐ根本的な治療法・予防法を開発する必要があります。それには、黒質においてドーパミンを分泌する神経細胞がなぜ死んでいくのか、原因を解明しなければなりません。
その重要な手掛かりとなるのが、パーキンソン病患者の脳の黒質において、ドーパミンを分泌する神経細胞の内部に現れるレビー小体です(図1)。それは主にα-シヌクレインというタンパク質が集まった凝集体です。
「レビー小体は、その構造さえよく分かっていません。まず、それを調べる必要があります」。大阪大学教授の望月秀樹さんはそう指摘します。望月さんはパーキンソン病の発症の仕組みを解明し、根本的な治療法・予防法を開発することを目指した研究を長年進めてきました。その望月さんの研究室に2011年、大学院生として入ってきたのが、荒木克哉さんです。「彼は、京都大学で物理学を学んだ後に、医学に転じました。私はこれまで、病気に関係するタンパク質の構造解析を依頼する形で物理系の先生たちと共同研究を進めてきました。物理学と医学の両方に詳しい荒木さんならば、物理系の先生たちと解析データについて医学的な観点から議論しながら研究を進展できると思いました」と望月さん。こうして荒木さんは、望月さんの指導のもと、レビー小体の構造を調べる研究を始めました。
レビー小体の画像は(https://commons.wikimedia.org/wiki/File:DLB_frontal_lewy_bodies_HE.jpg?uselang=ja)より引用。作者Jens florian氏
脳内の“混ざり物”を解析する難しさ
レビー小体が発見されたのは、約100年前です。その構造がいまだに分からないのはなぜでしょうか。
現在、10万種類以上のタンパク質の構造が原子スケールの解像度で解析されています。その多くは、X線結晶構造解析法で構造が明らかになったもので、手法としては大腸菌などに目的のタンパク質をつくらせ、きれいに並んだ結晶にしてX線を当て、得られた回折像から構造を解析します。
「ある文献によると、レビー小体はα-シヌクレイン以外にも90種類ほどのタンパク質が含まれています。そのような“混ざり物”をきれいに並べて結晶化することはできません。そのため、X線結晶構造解析法が使えないのです」と荒木さんは説明します。
レビー小体の主成分であるα-シヌクレインの構造についてはどのようなことが分かっているのでしょうか。従来、タンパク質はすべて、それぞれ特定の構造になることで、ほかのタンパク質などと結合して機能を発揮すると考えられてきました。「ところが近年、特定の構造を持たずに働く天然変性タンパク質がたくさんあることが分かってきました。α-シヌクレインは、典型的な天然変性タンパク質です」と荒木さんは解説します。
これまでのレビー小体の研究では、大腸菌などにα-シヌクレインをつくらせ、それを試験管内で凝集させてレビー小体をつくる実験が行われてきました。α-シヌクレインの溶液に振動や超音波を与えると、アミロイド線維と呼ばれる構造ができます。そのアミロイド線維はβシートと呼ばれる平面的な構造が規則的に並んだクロスβ構造から成ります。しかし、アミロイド線維から人工的にレビー小体をつくる実験には成功していません(図2)。さらにこれまでの研究により、線維化の過程でできるプロトフィブリル化したα-シヌクレインが毒性を持つという説や、プロトフィブリルがほかのα-シヌクレインのプロトフィブリル化を促すという説もあり、これらのことから実際にヒトの脳内にあるレビー小体の構造解析がますます注目される状況となっています。
「レビー小体を電子顕微鏡で撮影した従来の像では、レビー小体に集まっている成分がタンパク質なのか脂質なのかを区別することもできませんでした。そこで分子微細構造解析が専門である大阪大学の難波啓一教授に相談したところ、“レビー小体の構造解析には、SPring-8が向いているかもしれない”、とアドバイスを頂きました。そして、高輝度光科学研究センターの八木直人さんを紹介していただきました」と荒木さんは振り返ります。
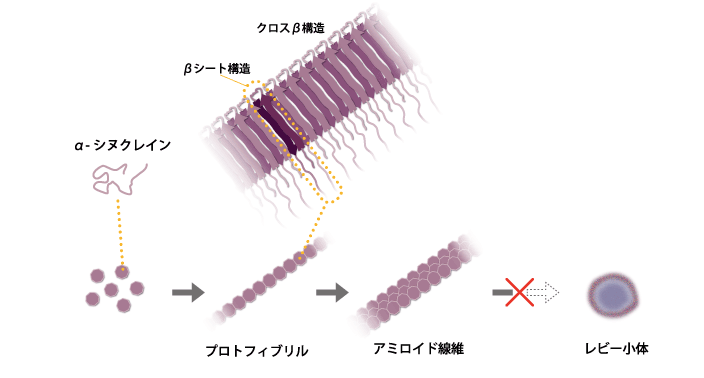
α-シヌクレインの溶液に振動や超音波を与えると、いくつかの分子が結合してβシート構造からなる線維状のプロトフィブリルができ、さらにβシート構造が規則的に並んだクロスβ構造から成るアミロイド線維ができる。しかし、アミロイド線維からレビー小体をつくる実験には成功していない。
SPring-8の強い赤外線で構造解析に成功
こうしてSPring-8を使った荒木さんと八木さんたちの共同研究がスタートしました。荒木さんたちは、レビー小体を赤外分光で解析することにしました。赤外分光を利用する利点としては、赤外線を試料に当てると、構造によって特定の波長(色)が吸収されるため、試料を透過した光を計測することで、試料の構造と濃度に関する情報が得られます。また、これまでの研究から、βシート構造に赤外線を当てると、どの波長が吸収されるかはすでに知られているので、透過光を計測することでβシート構造の存在を確認することができます。
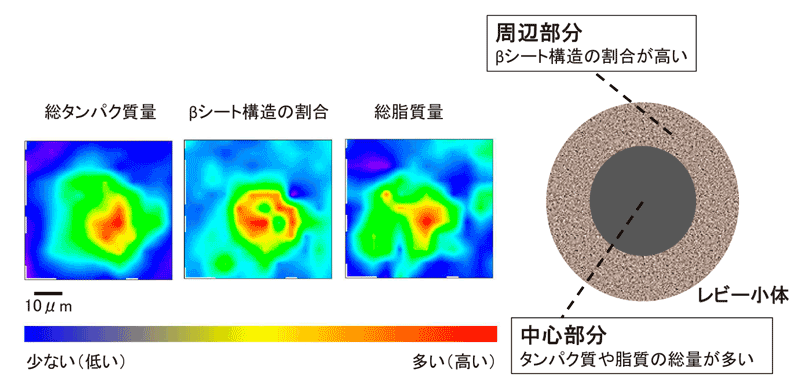
荒木さんたちはSPring-8のビームラインBL43IRを使い、パーキンソン病剖検脳の神経細胞内にある半径が約10マイクロメートル(0.01ミリメートル)のレビー小体に、直径数マイクロメートルの赤外線ビームの位置を少しずつずらしながら当てて計測しました。それにより、タンパク質や脂質の総量は中心部分で多いこと、βシート構造の割合は、中心部よりも周辺部分で高いことが分かりました(図3)。βシート構造のようなタンパク質の部分構造が分かるレベルで、レビー小体の構造解析に成功したのは世界で初めてです。成功の要因を荒木さんはこう語ります。
「ヒトの脳内のレビー小体のような“混ざり物”に、実験室にある普通の装置の赤外線を当てても、ノイズだらけで、きれいなデータは得られません。そのため、脳内の凝集体をタンパク質の濃度分布という形で解析しようとした人がほとんどいませんでした。今回私たちは、SPring-8の強くて微小な赤外線ビームを使うことで、きれいなデータを取ることができたのです」。
荒木さんたちはSPring-8でX線による解析も進めています。結晶化しなくても、βシート構造が規則的に並んだクロスβ構造にX線を当てると、特徴的な回折像が得られます。「しかし、その特徴的な回折像は現在まだ見えていません。試験管内の凝集実験とは異なり、実際のヒトの脳内にあるレビー小体では、クロスβ構造はできていないのかもしれません」と荒木さんは推定しています。
レビー小体と細胞死の因果関係を探る
今回の研究成果について、望月さんは次のように語ります。「実は、神経細胞の細胞死とレビー小体の因果関係も不明です。毒性のある構造を持つタンパク質や脂質をレビー小体が閉じ込めて神経細胞を保護しているのか、あるいは、レビー小体自体に毒性があり細胞死を引き起こすのか分からないのです。それにより細胞死を食い止める治療法の開発方針も異なります。今回のような構造解析が、細胞死との因果関係を解明する有力なアプローチになるはずです。今後ともぜひ八木さんたちと共同研究を続け、レビー小体の構造解析をさらに進めていきたいと思います」。
凝集体ができる脳の病気は、アルツハイマー病などたくさんあります。荒木さんたちがSPring-8で始めた、ヒトの脳内にある凝集体を構造解析するという新しい取り組みは、パーキンソン病だけでなく、脳のさまざまな難病を根本的に治療・予防する重要な手掛かりを提供すると期待されます。

父の病気を理解したいと医学部へ
京都大学で原子核物理や物性物理を学んだ荒木さん。「京都大学に入学したころ、父が脊髄小脳変性症を発症しました」と振り返ります。TVドラマや映画になった『1リットルの涙』でも紹介された脊髄小脳変性症は、小脳の神経細胞が死んでいき運動機能に支障が現れる進行性の難病で、いまだに有効な治療法はありません。「お医者さんの説明を聞いても、なぜ治らないのか納得できませんでした。せめて父に何が起きているのか、その病気を理解したいと思い、大阪大学医学部に入りました」。物理学から医学に転じた理由を、荒木さんはそう打ち明けてくれました。
「高い志を持ち、物理学と医学の両方が分かる荒木さんだからこそ、八木さんたちとの共同研究が大きく進展しました。今回のレビー小体の構造解析は、タンパク質の国際学会でも、高く評価されました」と望月さんはうれしそうに語ります。

望月さん(左)と荒木さん(右)
文:フォトンクリエイト 立山 晃
この記事は、大阪大学大学院医学系研究科神経内科の望月秀樹教授と、荒木克哉 医員(現在、市立豊中病院神経内科が本務)にインタビューして構成しました。