オートファジーが始まる仕組みが構造から見えてきた
研究成果 · トピックス
「オートファジーのメカニズムの発見」により、大隅良典さん(東京工業大学栄誉教授)に2016年のノーベル医学・生理学賞が贈られました。オートファジーは、酵母や植物、動物など、すべての真核生物に備わっている細胞内の浄化・リサイクルシステムです。細胞内の変性タンパク質や不良ミトコンドリア、さらには細胞内に侵入した病原性細菌などを分解して浄化することで、さまざまな病気から生体を守っています。また栄養状態が悪くなったとき、過剰なタンパク質を分解して、生存に必要なタンパク質にリサイクルします。
大隅さんは1993年、酵母を使った実験により、オートファジーに欠かせない遺伝子を14種類発見し、それらの遺伝子からつくられるAtgと呼ばれるタンパク質群の機能を調べる研究を進めました。「その1993年の論文が、ノーベル賞で最も評価されたものです。現在、酵母の主要Atgタンパク質は18種類知られていますが、大隅先生はその大半を1993年に発見され、オートファジー研究の礎を築かれたのです」。微生物化学研究所の野田展生さんはそう解説します。
タンパク質の構造が分からなければ、その機能メカニズムを解明することはできません。そこで大隅さんは2001年、北海道大学の教授だった稲垣冬彦さんにAtgタンパク質の構造解析を依頼しました。その解析を担当したのが、学位を取って稲垣研究室に赴任したばかりの野田さんでした。「当時Atgタンパク質群の構造解析は1種類も行われていませんでした」。こうして野田さんたちは、世界に先駆けて、タンパク質の構造からオートファジーの仕組みに迫る研究を始めました。
何でも分解できるオートファジー
ここでオートファジーの過程を簡単に見てみましょう。オートファジーが始まるとき、まず膜で囲まれた小さな袋ができます(図④)。その袋が大きくなり、へこむように変形して分解する物質を閉じ込めます(図⑤)。この袋をオートファゴソームといい、数分から10分以内に完成します(図⑥)。そして、酵母や植物では液胞、動物ではリソソームと呼ばれる分解酵素が入った器官とオートファゴソームが融合して、物質が分解されます(図⑦)。
「オートファジーは、タンパク質や脂質だけでなくミトコンドリアなど、何でも分解することができます。ただし、分解し過ぎて細胞が死に至ることは、普通はありません。何でも分解できてしまう危険な仕組みが必要なときだけに始まり、不要なものを選択的に分解するように高度に制御されています。そこがオートファジーのすごいところです」と野田さんは言います。
最初の袋ができる仕組みが分かった
野田さんと大隅さんたちは、オートファジーの仕組みを調べる共同研究を続けてきましたが、まだ分からないことがたくさんあります。その1つが、オートファゴソームがつくられる仕組みです。
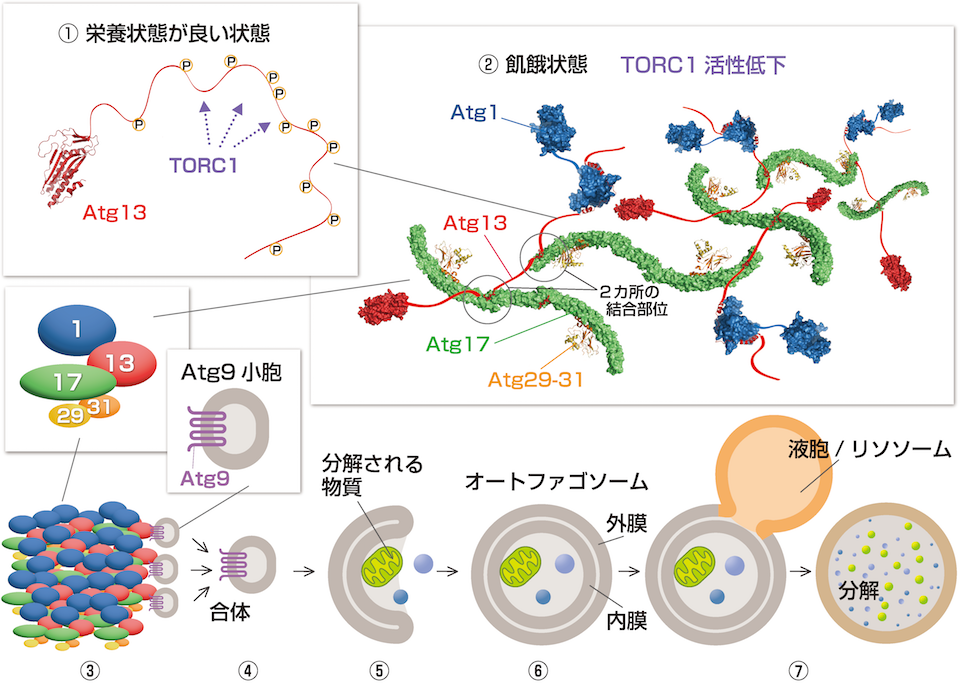
野田さんと大隅さんたちは2016年、SPring-8を用いたX線結晶構造解析により、オートファゴソームができる最初の段階の仕組みを解明することに成功しました。オートファジーは、細胞が飢餓状態になったときなどに始まります。細胞内には、栄養状態のセンサーの役割をするTORC1という酵素があります。栄養状態がよいときには、TORC1がAtg13にリン酸を付け続けて、オートファジーが始まらないように抑えています(図①)。
細胞が飢餓状態になると、TORC1の活性が低下してAtg13からリン酸が外れます。するとAtg13はAtg17と結合できるようになります(図②)。
野田さんは、Atg13とAtg17が結合した複合体の構造を解析しました。「Atg13の大部分はひも状の構造で、そこに2カ所の結合部位があり、Atg13の1本のひもで2つのAtg17をつなぎとめることが分かりました。こうしてAtg13とAtg17はたくさんつながり、そこにAtg1、Atg29、Atg31も集まった巨大な複合体ができるのです」(図②〜③)。
この巨大な複合体がオートファゴソームの最初の袋をつくる土台となります。「細胞内には、Atg9を数十分子埋め込んだ膜でできた小さな袋(Atg9小胞)がたくさん漂っています。1個ずつのAtg13とAtg9の結合力はとても弱いので、普段はAtg13にAtg9小胞が集まることはありません。ところがAtg13をたくさん含む複合体ができると、そこにAtg9小胞が3個ほど結合し、Atg9小胞同士が合体してオートファゴソームの最初の袋になると考えられます」(図③〜④)。
野田さんたちは、試験管内にAtg13やAtg17が集まった複合体とAtg9小胞を混ぜて、いくつかのAtg9小胞が合体した袋ができるかどうか確かめる実験を始めています。
まだ3合目
3個ほどのAtg9小胞が合体して小さな袋ができた後、そこに細胞内から膜が集まってきて、袋が大きくなります(図④〜⑤)。「どこから膜が供給されるのか、それがどのような仕組みで集まってきて袋が大きくなるのか、それはまだ謎です。そこでもAtg9が重要な働きをしていると予想されますが、その構造はまだ解析されていません。私たちはAtg9の結晶をつくり、構造解析することを目指しています」。
タンパク質の構造を解析するための代表的な手法が、結晶をつくってX線で測定するX線結晶構造解析です。ただし、Atg9のような膜タンパク質や複数のタンパク質から成る複合体は大きな結晶をつくることが難しいという問題があります。「小さな結晶しかつくれない場合も多いのですが、SPring-8ならば、そのような微小結晶でも構造解析ができます」。
オートファジーには、さらに大きな謎が残されています。「その一つは、分解する物質を閉じ込めるために、袋が大きくへこむように変形する仕組みです。その変形でもAtg9が関係しているかもしれません」。
完成したオートファゴソームは内膜と外膜の2層構造になります(図⑥)。「液胞やリソソームに融合すると、内膜は閉じ込めた物質とともに分解されます。しかし外膜は分解されずに、液胞やリソソームの膜の一部となります(図⑦)。なぜ、内膜だけが分解されるのか、それも大きな謎です。大隅先生はオートファジー解明の道のりは、まだ3合目だとおっしゃっています」。
緊密な共同研究で10合目を目指す
「構造解析を進める研究者は、ある現象で働くタンパク質を解析したら、次はまったく別の現象のタンパク質を対象にする人も多いようです。私はオートファジーに関わるタンパク質にターゲットを絞って構造解析を進めてきました。オートファジーは1種類のタンパク質の構造を解いただけでは現象の仕組みが分からない巨大システムです。たくさんのタンパク質の構造を解析することで、ようやくオートファジーの仕組みの一端が見えてきます。そこが、大変ですが、面白いところです」。
生命現象の仕組みを解明するには、大隅さんのように、現象に関わる遺伝子・タンパク質を突き止めてその機能を調べる“機能解析”と、野田さんのように、タンパク質の構造を解析して機能メカニズムを調べる“構造解析”の両方が必要です。
野田さんは、大隅さんとの共著論文が最も多い研究者です。「私は2011年に北海道大学から微生物化学研究所(東京都)に移った後は、東京工業大学の大隅研究室(神奈川県)のセミナーに毎週、参加しています。機能解析と構造解析の研究者による、このような緊密な共同研究は、ほかに例がないと思います」。
オートファジーは、がんやパーキンソン病などさまざまな病気や、老化とも関係が深いことが分かってきました。野田さんは、ヒトやマウスなど哺乳類のオートファジーの研究を進めている水島昇さん(東京大学大学院教授)との共同研究も行っています。
「私は薬学部の出身で創薬などの応用研究にも興味がありました。ただし現在は、質の高いサイエンスを進めれば、おのずと応用につながると考え、オートファジーの仕組みに迫る基礎研究を進めています」。

稲垣冬彦先生の先見の明
2016年6月、稲垣冬彦さんが亡くなられました。「とても優しい先生でした。大隅先生のノーベル賞受賞を知れば、どんなに喜ばれたことでしょう……」と野田さん。
「2001年、稲垣先生が大隅先生から構造解析を頼まれたのは、Atg8だけだったそうです。ところが稲垣先生は、1種類だけでは現象の仕組みは分からない。Atgタンパク質をすべて構造解析したいと言われ、長年にわたる共同研究が始まりました。稲垣先生は、構造から生命現象の仕組みを解明したいという思いが強く、大隅先生と意気投合されました。当時、研究者の間でもまだあまり知られていなかったオートファジーの重要性を見抜く先見の明を、稲垣先生はお持ちだったのです」。

2006年オートファジー国際会議にて、
左端から野田さん、大隅さん、(後列)足立さん、佐藤さん、(前列)稲垣さん、藤岡さん
文:フォトンクリエイト 立山 晃
この記事は、公益財団法人 微生物化学研究会 微生物化学研究所 分子構造解析部の野田展生 主席研究員にインタビューして構成しました。