Mnを用いたMAD実験による単量体型イソクエン酸脱水素酵素の立体構造解析
問い合わせ番号
SOL-0000001631
ビームライン
BL41XU(生体高分子結晶解析 I)
学術利用キーワード
| A. 試料 | 生物・医学 |
|---|---|
| B. 試料詳細 | 生体高分子、結晶, 蛋白質, 医薬品 |
| C. 手法 | X線回折, 吸収、及びその二次過程, 蛍光X線 |
| D. 手法の詳細 | 単結晶構造解析, MAD, XAFS |
| E. 付加的測定条件 | 低温(〜液体窒素) |
| F. エネルギー領域 | X線(4~40 keV) |
| G. 目的・欲しい情報 | 分子構造, 構造解析, 機能構造相関, 電荷密度 |
産業利用キーワード
| 階層1 | 製薬 |
|---|---|
| 階層2 | ドラッグデザイン, 製剤 |
| 階層3 | タンパク質, 薬物 |
| 階層4 | 結晶構造 |
| 階層5 | 回折, X線散乱 |
分類
M10.10 単結晶回折, M40.10 XAFS
利用事例本文
多波長異常分散(MAD)法は、結晶を構成する分子が重原子を有している場合、1つの試料結晶から位相情報を得ることの出来るとても強力な手法です。
本事例では、A. vinelandii 由来の単量体型イソクエン酸脱水素酵素の立体構造を、分子に結合したマンガン原子を利用したMAD実験で決定しました。
試料タンパク質には、A. vinelandii 由来の単量体型イソクエン酸脱水素酵素を塩化マンガン存在下で結晶化したものを用いました。
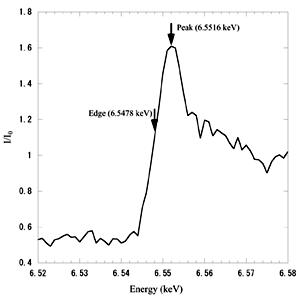
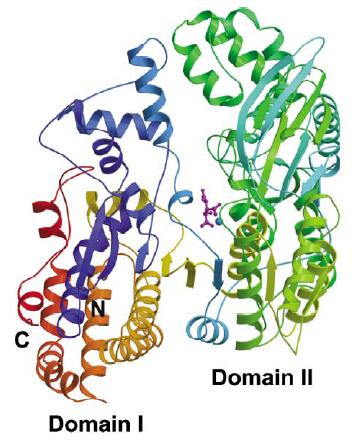
この試料結晶のX線吸収スペクトルを測定してマンガンのX線吸収端を決定しました(図1)。決定されたX線吸収端近傍でMAD実験を行い、単量体型イソクエン酸脱水素酵素の立体構造を1.95Å分解能で得ることに成功しました(図2)。
図1. 測定されたMnのX線吸収スペクトル
図中の矢印(Edge、Peak)はX線回折実験に用いられた波長を示しています。
図2. 決定された単量体型イソクエン酸脱水素酵素の構造モデル
図中央の青い球が結合しているMn原子です。
[ Y. Yasutake, S. Watanabe, M. Yao, Y. Takada, N. Fukunaga, I. Tanaka, Acta Crystallographica Section D 57, 1682-1685 (2001), Fig. 2,
©2001 International Union of Crystallography ]
画像ファイルの出典
原著論文/解説記事
誌名
Y. Yasutake et al., Acta. Cryst. D57, 1682-1685 (2001)
図番号
2
測定手法
多波長異常分散(MAD)法は、結晶を構成する分子が重原子を有している場合、1つの試料結晶から位相情報を得ることの出来るとても強力な手法です。
画像ファイルの出典
図なし
測定準備に必要なおおよその時間
1 時間
測定装置
| 装置名 | 目的 | 性能 |
|---|---|---|
| タンパク質結晶用回折装置 | X線回折像の記録 | |
| ペルチェ冷却型Si-PINフォトダイオード | X線吸収スペクトルの測定 |
参考文献
| 文献名 |
|---|
| Y. Yasutake et al., Acta Cryst., D57, 1682-1685 (2001) |
| Y. Yasutake et al., Structure, vol. 10, 1637-1648, Dec. (2002) |
関連する手法
アンケート
SPring-8だからできた測定。他の施設では不可能もしくは難しい
本ビームラインの主力装置を使っている
測定の難易度
熟練が必要
データ解析の難易度
中程度
図に示した全てのデータを取るのにかかったシフト数
2~3シフト