肝臓がん原因タンパク質の構造と機能を解明 - 複合体タンパク質のX線結晶構造解析 - (プレスリリース)
- 公開日
- 2007年02月15日
- BL26B1(理研 構造ゲノムI)
平成19年2月15日
独立行政法人理化学研究所
国立大学法人東京大学
本研究成果のポイント
○ 肝臓がん遺伝子産物「ガンキリン」とタンパク質分解を行うサブユニットとの複合体構造を決定
○ ガンキリンが促進する、がん抑制タンパク質の分解機構の解明
○ 新しい抗がん剤創製などへの応用研究に期待
|
独立行政法人理化学研究所(野依良治理事長)と国立大学法人東京大学(小宮山宏総長)は共同で、肝臓がん遺伝子産物のガンキリンと、タンパク質分解を行う26Sプロテアソーム※1のサブユニットとの複合体の立体構造を解明しました。これは、理研ゲノム科学総合研究センター(榊佳之センター長)タンパク質構造・機能研究グループのプロジェクトディレクターで国立大学法人東京大学大学院理学系研究科教授の横山茂之、バラスンダラム・パドマナバン上級研究員、中村祥浩および中野和民リサーチアソシエイトらの研究グループによる成果です。 (論文) |
1.背 景
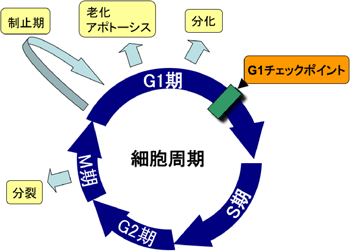
細胞は、栄養状態や環境を検知してDNA合成をすべきか否かチェックするG1期、DNAを合成するS期、DNA合成の完了をチェックして染色体分配の準備をするG2期、染色体の分配と細胞分裂を行うM期という4期の細胞周期を規則正しく繰り返して行い増殖します。細胞周期の進行を調節する重要な時期の1つが、G1期とS期の境目にG1チェックポイントとして存在します。細胞周期はいったんこの時期を通過すると、外界の状況がどのような環境であれ進行します(図1)。細胞は、その進行を調節する役割を持つタンパク質群によって、このようなチェックポイントを厳密に制御しています。がんはその制御機構に異常をきたした結果引き起こされる疾患の一つで、細胞周期の進行を抑制する働きが壊れ、細胞が異常増殖を繰り返してしまいます。
がんタンパク質の一種であるガンキリンは、肝臓がん腫瘍形成時の初期段階に大量に発現することが明らかになっています。またガンキリンは、ユビキチン化を行うタンパク質や、26Sプロテアソームのサブユニットと複合体を形成することもわかっていました。さらに、G1チェックポイントの進行と停止に関わるタンパク質であるCDK4やがん抑制タンパク質でもあるpRbなどに作用し、pRbやp53の分解を促進することが知られています。このようにガンキリンは様々な細胞周期調節タンパク質と相互作用し、細胞分裂を促進する働きがありますが、細胞内に過剰に蓄積すると、肝臓がん細胞の異常増殖を引き起こす原因の一つになると考えられています。しかし、ガンキリンがこれらの細胞周期調節タンパク質群とどのように相互作用するのかについては、その詳細な認識機構は不明でした。
2.研究手法と結果
研究グループでは、ガンキリンと26Sプロテアソームのサブユニットドメイン(S6ATPaseドメイン)との結合様式を明らかにするために、X線結晶構造解析の手法を用いてガンキリンとS6ATPaseドメイン複合体の立体構造を解析しました。最初に、ガンキリンとS6ATPaseドメインを大腸菌内で共発現させることでガンキリン/S6ATPaseを複合体化させ、ガンキリン/S6ATPaseタンパク質複合体の結晶を得ました。この結晶を用いて、大型放射光施設(SPring-8)※3の理研構造ゲノム I ビームラインBL26B1にて回折X線測定を行い、約2.3 Å(オングストローム)という高分解能※4で複合体の立体構造を決定しました。
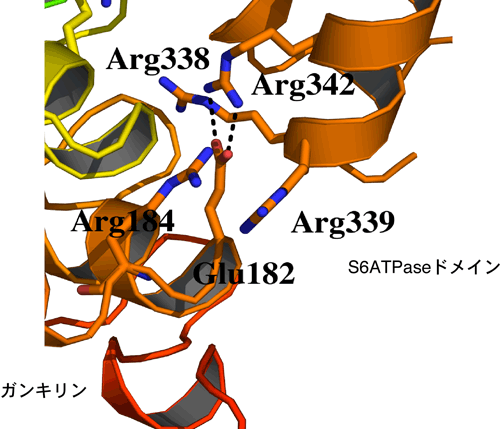
得られた立体構造から、ガンキリンとS6ATPaseは、ガンキリン1分子とS6ATPase1分子がそれぞれ静電気的な相互作用を中心として結合していることがわかりました(図2、図3)。さらに結合部位について詳細に検討したところ、ガンキリンタンパク質中の182番目のグルタミン酸※5は、S6ATPaseの342番目のアルギニン※6とも結合していることがわかりました(図4)。このグルタミン酸は、pRbタンパク質のガンキリン認識部位であることが知られています。さらに、生化学的な研究の結果、S6ATPaseに結合するこのグルタミン酸は、ガンキリン/S6ATPase複合体ではいくつかの結合の1つであること、一方、pRbはこのグルタミン酸に依存して、ガンキリン単体にも、ガンキリン/S6ATPase複合体にも結合できることが明らかになりました。これらの結果は、ガンキリンタンパク質上でS6ATPaseとpRbが置き換わることを示唆する重要な知見と考えられます。
以上のことから、ガンキリンによって促進されるpRbの分解は、ガンキリンが182番目のグルタミン酸を中心として結合したpRbを26SプロテアソームのS6ATPaseまで輸送し、ガンキリン上でpRbとS6ATPaseとを置き換えることにより、効率良くpRbをプロテアソームに引き渡すことに起因するという新規のメカニズムを提案し、このことが、ガンキリンが細胞の異常増殖を引き起こす主要な原因であると考えました。
3.今後の展開
ガンキリンによって引き起こされる細胞周期の調節に重要であり、がん抑制タンパク質のひとつであるpRbの分解機構が、X線結晶構造解析と生化学的実験により詳細に解明できたことは、薬剤設計への展開に新しい手がかりを与えたことになります。具体的には、ガンキリン上のS6ATPaseおよびpRbの共通の結合部位を特異的に認識する化合物の探索や、あるいはペプチドについて、SBDD (Structure Based Drug Design)の手法を用いて検討することが可能になります。例えば、ガンキリンのS6ATPaseやpRbへの結合を軽減させる複合体構造に基づいた阻害剤、あるいはpRbの分解促進抑制剤などとして期待されます。この薬剤は、ガンキリン依存性の細胞の異常増殖を抑制することが可能な、新規の抗がん剤になる可能性があります。
一方で現在、細胞周期を調節するタンパク質群はそれぞれが複合体を形成することで、機能の調節を行っていることが明らかになりつつあります。本研究を足がかりとして、細胞周期を調節するタンパク質群の複合体の構造や機能解析を行い、その調節機構の解明を進めていくことは、様々なケースのがんに対応可能な創薬の開発に有用な知見をもたらすことが期待できます。
<参考資料>
細胞周期はG1-> S -> G2 -> M -> G1 期と規則的に順序よく進行する。G1チェックポイントは、細胞周期を開始する関所のようなものであり、いったんこのチェックポイントを通過した細胞は次のG1期に至るまで細胞周期を進めていく。通過しなかった場合は、そのままG1期にとどまるか、制止期と呼ばれる特別な状態に入り休止状態になる。細胞の置かれている環境によっては老化やアポトーシスなどに進む場合もある。
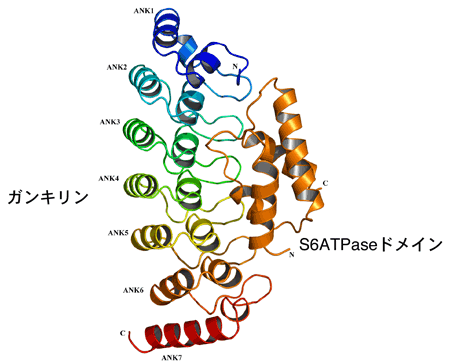
ガンキリンとS6ATPaseの複合体は、ガンキリン1分子にS6ATPase1分子が、ガンキリンの窪みにはまるように結合していた。さらに詳細を見ると、ガンキリンは、7つのアンキリンリピートドメイン(ANKと略)と呼ばれる繰り返し構造が規則正しく並び、全体として手のひらを丸めたような構造をしていた。一方、S6ATPaseドメインは、4つのαへリックスが束になった形をしていた。
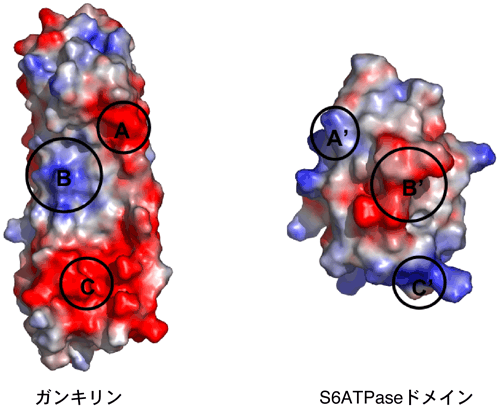
ガンキリンとS6ATPase複合体は、正に荷電した部位(青)と負に荷電した部位(赤)のうち、AとA'、BとB'およびCとC'の3カ所それぞれが、互い引き合うことにより安定な複合体を形成していた。
pRbとの結合に必要なガンキリンタンパク質中の182番目のグルタミン酸は、S6ATPaseの342番目のアルギニンと水素結合をしており、さらにグルタミン酸周辺にかぶさるように、S6ATPaseが存在していた。
<用語解説>
※1 26Sプロテアソーム
26Sプロテアソームはユビキチンで修飾されたタンパク質をATP依存的に分解する酵素である。活性型の26Sプロテアソームはタンパク質分解実行ユニットである20Sプロテアソームの両端に、それを制御する19S 複合体が会合した巨大で複雑な分子複合体(分子量250万、総サブユニット数約100個から構成)である。
※2 ユビキチン化
タンパク質の翻訳後修飾の一種で、76個のアミノ酸からなるユビキチンのカルボキシル末端が、別のタンパク質のリジン残基側鎖のアミノ基とイソペプチド結合により枝分かれ状に結合したもの。ユビキチンが1分子だけ結合する場合(モノユビキチン化)と、ユビキチンにさらにユビキチンが結合することによって鎖状に伸長する場合(ポリユビキチン化)がある。
※3 大型放射光施設(SPring-8)
兵庫県にある大型共同利用施設。ほぼ光速で進む電子が、その進行方向を磁石などによって変えられると接線方向に赤外線や可視光線、紫外線やX線などを含む電磁波が発生する。これが放射光であり、電子のエネルギーが高く、進行方向の変化が大きいほど、X線などの短い波長を含むようになる。第三世代の大型放射光施設と呼ばれるものには、世界にSPring-8、APS(アメリカ)、ESRF(フランス)の3つがある。
※4 高分解能
Å(オングストローム:1×10-10メートル(=0.1ナノメートル))の単位を用いて表し、この数字が小さいほど分解能が高く、予路精度の高い高解像度であることを示す。
※5 グルタミン酸
タンパク質を構成する20種類のアミノ酸の一つで、酸性極性アミノ酸に分類されるアミノ酸である。GluあるいはEの略語で表される。コンブのうまみ成分の元として同定された。動物では神経伝達物質としても使用されている。
※6 アルギニン
タンパク質を構成する20種類のアミノ酸の一つで、塩基性極性アミノ酸に分類されるアミノ酸である。ArgあるいはRの略語で表される。核タンパク質での含量が多く、核酸との結合に関与している。
|
<本件に関する問い合わせ先> 独立行政法人理化学研究所横浜研究所 タンパク質構造・機能研究グループ (報道担当) <SPring-8についての問い合わせ先> 財団法人高輝度光科学研究センター 広報室 |
- 現在の記事
- 肝臓がん原因タンパク質の構造と機能を解明 - 複合体タンパク質のX線結晶構造解析 - (プレスリリース)