ジベレリン受容体の構造が明らかに - 植物の自在な生長調節を可能にする「第2の緑の革命」の起爆剤 - (プレスリリース)
- 公開日
- 2008年11月27日
- BL41XU(構造生物学I)
平成20年11月27日
国立大学法人名古屋大学
国立大学法人京都大学
独立行政法人理化学研究所
本研究成果のポイント
○植物ホルモン、“ジベレリン”の信号の受容体の原子構造を世界で初めて決定
○受容体によるジベレリンの分子認識の仕組みと受容体の分子進化が判明
○自在な草丈制御技術の開発による食糧の増産に期待
|
国立大学法人名古屋大学(平野眞一総長)および国立大学法人京都大学(松本紘総長)は、植物ホルモンの1つであるジベレリン※1の受容体※2の立体構造を初めて明らかにしました。名古屋大学生物機能開発利用研究センターの松岡信教授と京都大学大学院薬学研究科加藤博章教授らの研究グループによる成果で、文部科学省ターゲットタンパク研究プログラムの支援のもと、国立大学法人東京大学(小宮山宏総長)、独立行政法人理化学研究所(野依良治理事長)のグループとの共同研究により、大型放射光施設SPring-8を利用してX線結晶構造解析を行った成果です。 (論文) |
研究成果の概要
ジベレリンは、植物の生長、発芽、花芽の形成など多くの生理現象にかかわる植物ホルモンです。2005年、上記の名古屋大学のグループを中心に、ジベレリン分子と結合しその情報を細胞に伝えるタンパク質(このようなタンパク質を受容体と言い、ジベレリン受容体はGID1と名付けられました)の遺伝子が、イネから単離されました。このGID1受容体は、微生物から動植物まで広く存在するリパーゼという酵素とよく似ていました。しかし、この酵素に似たタンパク質がなぜ全く異なった働きである受容体の機能を持っているのかは不明でした。
今回の研究は、1)酵素に似たGID1受容体がどのようにジベレリンを認識するのか、2)ジベレリンとこの受容体の関係は植物進化のいつ頃、どのように作られたのか、という2つの点について明らかにするために、本タンパク質を結晶化しX線結晶構造解析を行いました。X線解析では、2006年までに京大加藤グループが文部科学省科学技術振興調整費の支援のもとで株式会社リガクと共同開発した微小タンパク質結晶用のX線回折装置と、理研の大型放射光施設SPring-8の構造生物学 I ビームラインBL41XUが活躍しました。
今回の発見では、以下の2点が明らかにされました。
1)GID1受容体の出現は、リパーゼの酵素反応を行うところ(これを活性ポケット呼び、酵素タンパク質の中では最も重要な部分と言えます)のアミノ酸がいくつか変化して、そこにジベレリンを結合できる形ができあがったためであること。
2)ジベレリン受容体の出現は、コケの出現(約4.3億年前)よりも後でシダの出現のころ(約4億年前)に遡ることができるが、シダのGID1受容体は、より進化した植物であるイネ(イネが含まれる被子植物の出現は2億年前)のGID1に比べてジベレリンの結合能力や認識能力においてかなり劣る。つまり、植物は進化の過程でGID1を改良してより巧妙に生長をコントロールする仕組みを身につけてきたこと。
GID1受容体の構造の特徴
予想通り、GID1受容体の全体構造は、リパーゼとまったく同じ骨格の構造(α/β水解酵素型構造)をしています(図1)。リパーゼの活性ポケットの部分がジベレリン(GA)の結合する位置(GA結合ポケット)に対応し、リパーゼでも見られる触媒アミノ酸トリオのうち2つのアミノ酸残基(セリン(Ser198)、アスパラギン酸(Asp296))やオキシアニオン結合部位なども保存されています(図2)。さらに、両方のタンパク質ともにN-末端側に「ふた」と名付けられた自由に動ける構造領域が存在します。これら立体構造の特徴を基にした洞察から、結合ポケットにジベレリンが入り込むとこの「ふた」が被さり、文字通りふたをする働きをしてジベレリンをポケット内に保つ、さらに、閉じた「ふた」の外側の構造の特徴を認識して、植物の別のタンパク質がGID1受容体と結合して植物細胞が生長するきっかけを作り出す、という一連の仕組みが解明されました。これらの結果から、GID1は酵素の役割を持つタンパク質から出発して、まったく働きが異なるジベレリンの受容体に進化したわけですが、その中身を細かく見ると、酵素として備えていたいくつかの構造的な特徴を巧みに変化させて受容体を出現させた、と言うことがよく分かります。
GID1受容体は、以前の研究より下等なシダから進化の進んだ被子植物(例えばイネ)まで広く存在していますが、コケにはないと考えられています。本研究では、シダとイネのGID1の違いについても調べました。イネのGID1受容体では、GA結合ポケットの構造の凸凹に結合したジベレリンの構造は良くフィットしています(図3)。しかし、シダのGID1では、GA結合ポケットの凸凹を構成するアミノ酸のいくつかが変わっていました。その結果、シダの受容体は、イネに比べて、ジベレリンに対する結合能力やジベレリンと似て非なる化合物との識別能力の2つの点で劣ることが分かりました。つまり、植物は進化の過程で、成長ホルモンであるジベレリンに対してその類似物質ときちんと区別を行い、鋭敏に反応する能力を獲得してきた、と言うことができます(図4)。
この研究は農業にとっても大きな意味を持ちます。たとえば、現在イネの栽培において、背丈が高くなりすぎ、倒れてしまうのを防ぐためにジベレリンの合成を押さえる薬剤を散布する場合があります。今回の研究成果を利用すれば、イネの受容体をジベレリンに対する反応性が鈍くなったものに置き換えてやることで、薬剤散布をする必要のないイネを作り出すことが可能です。逆に、作物の生長を今以上に促進させてやりたい場合は(たとえば現在話題になっている代替エネルギー作物の開発がそれに当たります)、ジベレリンに対する感受性をさらに高めてやることで可能となります。
このように、今回の発見は、植物科学の基礎的な知見を深めると同時に、農業にとって重要な作物の生長を人為的に制御できる手法を手に入れたと言う意味で、価値あるものと考えます。「第2の緑の革命」と言ってもよいのかもしれません。
《参考資料》
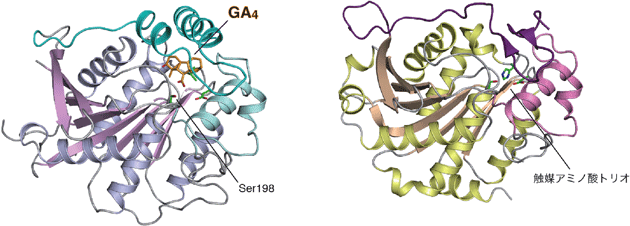 図1 リボンモデルで表示したジベレリン受容体とリパーゼの立体構造の比較
図1 リボンモデルで表示したジベレリン受容体とリパーゼの立体構造の比較a ジベレリン受容体、b リパーゼ。両者の基本構造は非常によく似ている。a、bにおいてそれぞれ薄紫色、金色で示したのがα/β水解酵素型構造。a、bにおいてそれぞれ濃緑色、濃紫色で示したのがN末端のリッド(ふた)。
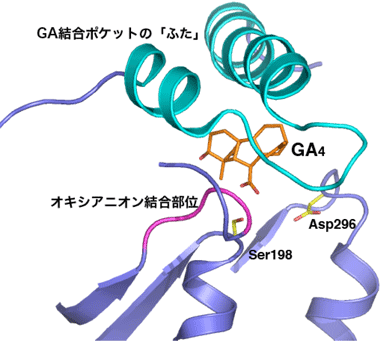 図2 ジベレリン受容体のジベレリン(GA)結合ポケットの拡大図
図2 ジベレリン受容体のジベレリン(GA)結合ポケットの拡大図活性型ジベレリン(GA4)は炭素原子をオレンジ、酸素原子を赤で表示した。リパーゼ触媒アミノ酸トリオに相当するSer198とAsp296は、炭素原子を黄色、酸素原子を赤で表示した。オキシアニオン結合部位は紫色、ジベレリン結合ポケットの「ふた」は水色で表示した。
《用語解説 》
※1 ジベレリン(GA)
植物の生長、発芽、花芽の形成、果実の肥大促進など多くの生理現象にかかわる植物ホルモン。現在130種類以上の構造が報告されているが、その多くは、植物に対して作用せず、活性型ジベレリン(=植物が反応できるジベレリン)は、僅かである。ジベレリンは、1926年に黒澤英一によりイネの馬鹿苗病から発見され、1935年薮田貞治郎により単離、命名された。なお、植物には、ジベレリンの他に、オーキシン、エチレン、サイトカイニン、アブシジン酸、ブラシノステロイドの5つのホルモンがある。
植物が反応できるジベレリンの条件は、(1) 6位炭素にカルボン酸がついていること、(2) 3位炭素に水酸基がついている(3) γ—ラクトン環がある(4) 2位炭素に水酸基がついていないこと、などが知られている。今回のGID1受容体の構造解析により、GID1受容体こそがこれらの構造的特徴を厳密に認識して結合するべきジベレリンとそうでない化合物を区別していることが明らかになった。以下、活性型ジベレリンの1つであるGA4の構造を示した。
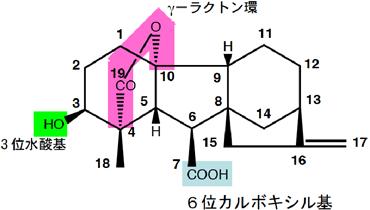 活性型ジベレリンGA4の構造
活性型ジベレリンGA4の構造番号は炭素の位置を示す。
※2 受容体(レセプター)
外界からの化学物質(リガンド)を受け取り(結合し)、細胞にその物質を受け取ったという情報を伝えるタンパク質のこと。細胞での存在場所の違いにより、細胞外の表面に存在する受容体と細胞内にある(核内)受容体の2つに分類される。GID1受容体は、核内受容体である。多くの核内受容体は、DNAと結合できる転写因子とよばれるタンパク質で、リガンドが結合すると特定の遺伝子の読み出しをオンにしたりオフにしたりする働きをする。GID1受容体のように酵素から進化して、DNAの結合には関係しない核内受容体は、きわめて珍しい。
※3 リパーゼ(脂質分解酵素)
脂質の加水分解反応を触媒(化学反応を加速する作用)し、微生物から高等動植物まで広く存在する重要な酵素。
全体構造としては、βシートからなる骨組みのまわりにα鎖が取り囲んでいるα/β水解酵素型という構造をしている。活性中心にセリン、アスパラギン酸、ヒスチジンからなる触媒アミノ酸トリオとよばれる3つのアミノ酸と、オキシアニオン(負に帯電した酸素をもつイオン)結合部位とよばれる場所があり、それぞれがリパーゼの化学反応に必要な部品である。また、N末端側のアミノ酸60個ほどは、可動性の「ふた」を形成し、脂質が来たら開いて活性ポケットに受け入れる作用をしているといわれている。
|
(問合せ先) 京都大学大学院薬学研究科 准教授 中津 亨 (記者発表に関する問い合せ先) (SPring-8に関すること) |
- 現在の記事
- ジベレリン受容体の構造が明らかに - 植物の自在な生長調節を可能にする「第2の緑の革命」の起爆剤 - (プレスリリース)
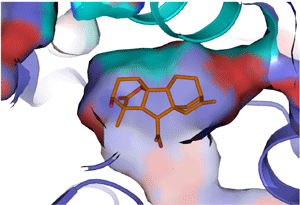 図3 ジベレリン受容体の結合ポケット内のジベレリンの様子
図3 ジベレリン受容体の結合ポケット内のジベレリンの様子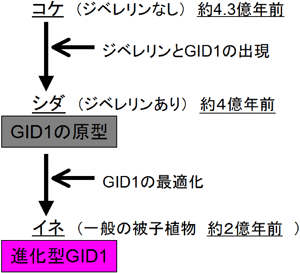 図4 ジベレリン受容体(GID1)の進化
図4 ジベレリン受容体(GID1)の進化