細胞内の不良品タンパク質を排除する酵素の構造と分子機構を解明-細胞におけるタンパク質品質管理の仕組みの理解に一助、神経変性疾患などの成因解明に期待-(プレスリリース)
- 公開日
- 2011年02月19日
- BL44XU(生体超分子複合体構造解析)
京都産業大学
九州大学
|
京都産業大学、九州大学、京都大学、大阪大学の研究グループ(代表:京都産業大学総合生命科学部 永田 和宏 教授;九州大学高等研究院(生体防御医学研究所)稲葉謙次 特別准教授)は、ほ乳類細胞の小胞体中で誤って生じたタンパク質ジスルフィド結合を切断し、不良品タンパク質の分解除去を促進する酵素ERdj5の高分解能結晶構造解析と分子機構の解明に成功しました。高等生物細胞の小胞体タンパク質の分解に関わる因子の全長構造を決定したのは、今回が世界で初めての例になります。 (論文) |
1.背 景
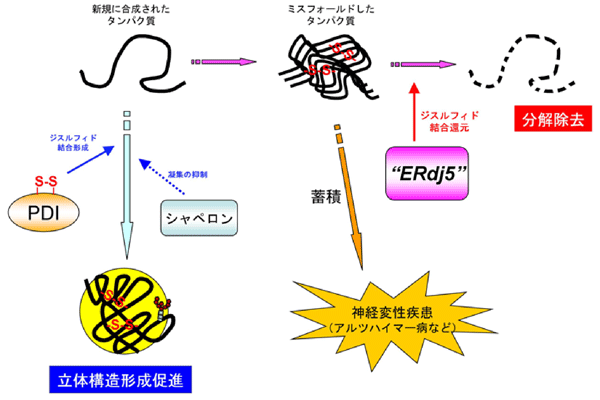
細胞内のタンパク質は、ある定められた区画の中で正しい立体構造を形成する(フォールドする)ことで、独自の機能を発揮します。しかしながら新規に合成されたタンパク質はある頻度で誤った立体構造をとり、速やかに分解除去される必要があります。このような細胞内のタンパク質品質管理システム(図1)が破綻すると、不良品タンパク質(ミスフォールディングタンパク質)が蓄積し、アルツハイマー病やハンチントン病、パーキンソン病などのフォールディング異常病を引き起こす要因となることが知られています。
蛋白質のフォールディングにおいて、ジスルフィド結合は重要な役割を担っています。ジスルフィド結合は、空間的に近くに位置する二つのシステインと呼ばれるアミノ酸が酸化されることにより形成される硫黄原子間の共有結合です。正しいシステインペアの間でジスルフィド結合が架かると、この結合が補強金具のように振るまい、蛋白質の立体構造を頑強なものにします。しかしながら、誤ったシステインペア間でジスルフィド結合が形成されると、タンパク質のミスフォールディングや凝集が誘起されます。誤ったジスルフィド結合のため凝集したタンパク質は膜に存在するチャネルを透過しにくく、また分解を受けにくい性質をもっています。そこで細胞内には、誤ったジスルフィド結合を開裂(還元)することで凝集タンパク質を解きほぐし、分解酵素プロテアソームが存在するサイトゾル※1へ膜透過チャネルを介して逆輸送し、分解除去を促進するシステムが存在することが分かってきました。特に、小胞体※2中で生じたミスフォールディングタンパク質を分解除去する機構は小胞体関連分解と呼ばれ、国内外で活発に研究が進められています。
2.内 容
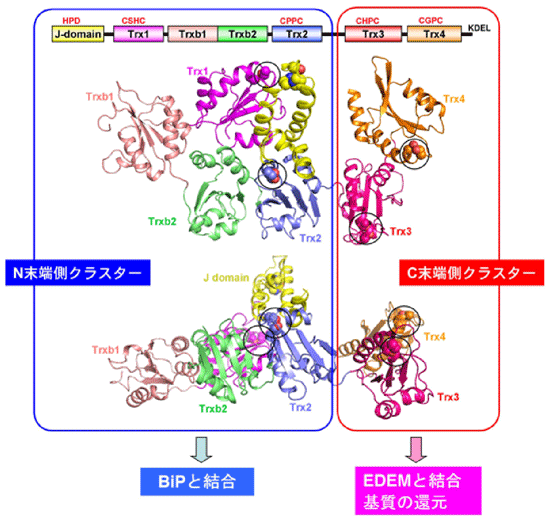
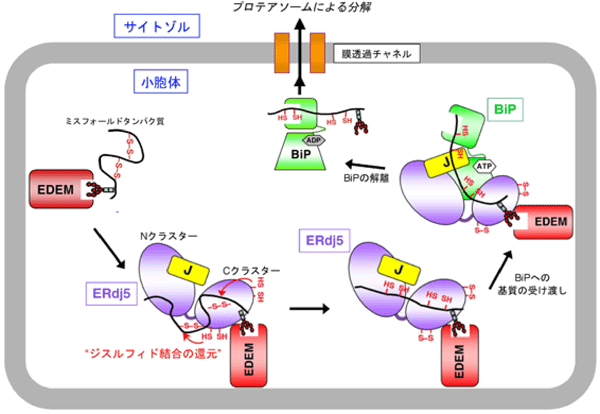
小胞体は全タンパク質の約30%を占める分泌タンパク質が合成される細胞内区画です。タンパク質ジスルフィド結合の形成は、主としてこの区画内で起こることが知られています。研究グループは一昨年、誤ったジスルフィド結合を還元することにより小胞体中のミスフォールドタンパク質の分解を促進する酵素ERdj5を発見し、報告しました(Ushioda et al., Science 321, 569-572, 2008)。今回の研究では、ERdj5の高分解能構造について、X線結晶構造解析という手法を用いて解析することに成功しました。X線回折のデータ収集は、大型放射光施設SPring-8のビームラインBL44XUと高エネルギー加速器研究機構のビームラインBL-5Aを用いて行いました。その結果、ERdj5は6つのチオレドキシンドメイン※3が同一平面上に並んだ構造をとり、N末端から4番目と5番目のチオレドキシンドメイン(Trx2とTrx3)を境に二つの領域(N末端側クラスターとC末端側クラスター)に分断されることが分かりました(図2)。さらに構造情報に基づき系統的な生化学実験および細胞生物学的実験を行ったところ、N末端側クラスターとC末端側クラスターの機能分担が解明されました。具体的には、ERDj5のC末端側クラスターがEDEMと呼ばれる因子によってリクルートされたミスフォールドタンパク質中の誤ったジスルフィド結合を還元し、次に、還元されたタンパク質が、ERdj5のN末端側クラスターに結合するBiPと呼ばれる因子に受け渡されることでタンパク質分解が促進されることが判明しました。すなわち本研究により、小胞体内で生じたミスフォールドタンパク質の認識・還元・受け渡しという一連のイベントを分子構造レベルで正確に記述できたと言えます(図3)。
3.今後の展開
研究グループは昨年、小胞体内のタンパク質ジスルフィド結合形成において中心的役割を担うEro1という因子の高分解能構造解析についても成功しました(Inaba et al., EMBO J, 29, 3330-3343, 2010)。今回のタンパク質ジスルフィド結合の開裂に関わる因子ERdj5の研究成果と合わせ、ほ乳類細胞の小胞体品質管理に関わる二つの重要な経路(タンパク質の高次構造形成の促進とミスフォールドタンパク質の分解)の作用機序を分子構造レベルで解明したと言えます。ここで得られた知見は、国内外で活発に研究が進められている「細胞におけるタンパク質品質管理」の学問分野の進展に大きく寄与するものであり、その基礎細胞生物学的な重要性は極めて高いと言えます。
細胞の中でミスフォールドタンパク質が過剰に蓄積することで、パーキンソン病やアルツハイマー病など種々の神経変性疾患を引き起こすことが知られております。本研究で得られた知見は、細胞の恒常性維持機構が破綻することに起因する疾病の成因解明さらには治療戦略にもつながり得るものです。
現在、ほ乳類細胞の小胞体中には、タンパク質ジスルフィド結合の形成あるいは開裂に関わる因子が20種類近く同定されておりますが、その多くの因子の具体的な機能は依然未解明です。今後、タンパク質ジスルフィド結合の形成・開裂に関わる他の因子についても構造及び機能発現メカニズムが解明されれば、細胞におけるタンパク質品質管理機構に関する理解がさらに深まることが期待されます。
《参考資料》
《用語解説》
※1 サイトゾル
細胞質から小胞体、ミトコンドリア、ペルオキソームなどの小器官を除いた液相領域。ここにタンパク質分解酵素プロテアソームが存在する。
※2 小胞体
真核細胞の小器官の一つ。ここで分泌蛋白質や膜蛋白質は合成される。ジスルフィド結合の形成や糖鎖の付加が起こる主要な場でもある。
※3 チオレドキシンドメイン
細胞内の酸化還元反応において中心的役割を担う分子量約12kDaのタンパク質ドメイン。活性部位には一組のシステインペア(Cys-Xaa-Xaa-Cysモチーフ)が存在する。
|
《問い合わせ先》 九州大学高等研究院(生体防御医学研究所 蛋白質化学分野) 京都産業大学総務部広報室 宮川 九州大学広報室 福島 (SPring-8に関すること) |
- 現在の記事
- 細胞内の不良品タンパク質を排除する酵素の構造と分子機構を解明-細胞におけるタンパク質品質管理の仕組みの理解に一助、神経変性疾患などの成因解明に期待-(プレスリリース)