ゲノムを変異から守る小さなRNAが作られる仕組みを解明(プレスリリース)
- 公開日
- 2012年10月15日
- BL32XU(理研 ターゲットタンパク)
2012年10月15日
科学技術振興機構(JST)
東京大学 大学院理学系研究科
ポイント
● トランスポゾン(動く遺伝子)はゲノム変異を引き起こすが、小さなRNAが抑制
● 小さなRNAを作るのに必須である、RNAを切断する酵素の正体を解明
● 不妊症の発症機構の解明や生殖医療への応用に期待
|
JST 課題達成型基礎研究の一環として、東京大学 大学院理学系研究科の濡木 理 教授、塩見 美喜子 教授、西増 弘志 特任助教、石津 大嗣 助教らの研究グループは、ゲノム(全遺伝子)を守る小さなRNA(リボ核酸)が作られる分子機構の一端を明らかにしました。 (論文) 本成果は、以下の事業・研究領域・研究課題によって得られました。 |
研究の背景と経緯
真核生物のゲノムにはトランスポゾンと呼ばれる動く遺伝子が存在します。トランスポゾンが、ゲノム上の別の位置に転移すると遺伝情報に変異が生じる可能性があるため、遺伝情報を次世代に正確に受け継ぐ必要のある生殖細胞では、トランスポゾンの発現や転移を抑えることが非常に重要です。生物にはトランスポゾンの発現や転移を抑える仕組みが備わっていますが、その仕組みに異常が生じると精子形成や卵形成の異常、ひいては不妊につながることが分かっています。
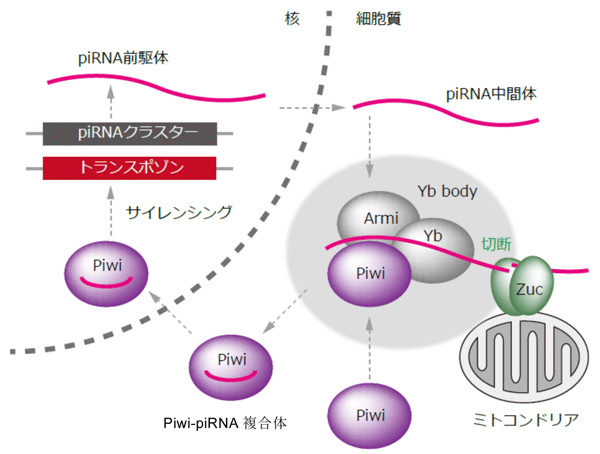
これまでの研究から、生殖細胞に発現しているpiRNA(PIWI - interacting RNA)とよばれる約30塩基からなる小さなRNAが、トランスポゾンの発現を抑えることで、生殖細胞のゲノムをトランスポゾンによる変異から保護する、つまり品質を管理する役割を担っていることが明らかになっていました。piRNAは、ゲノムの特定の領域から作られる長い一本鎖の非コードRNAがRNAを切断する何らかの酵素によって切断されることにより作られると考えられてきました。また、piRNAの産生にはズッキーニ(Zuc)たんぱく質を含むいくつかのたんぱく質が関わっていることが分かっていましたが、どのようなメカニズムでpiRNAが産生されるかは不明でした。
研究の内容
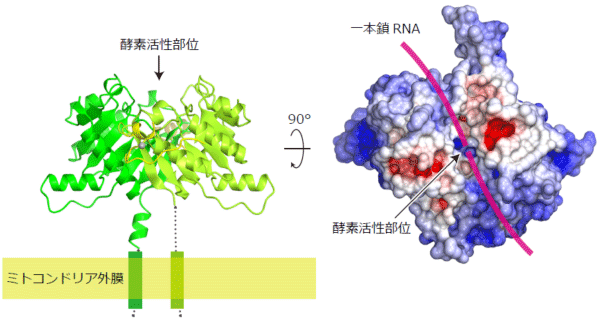
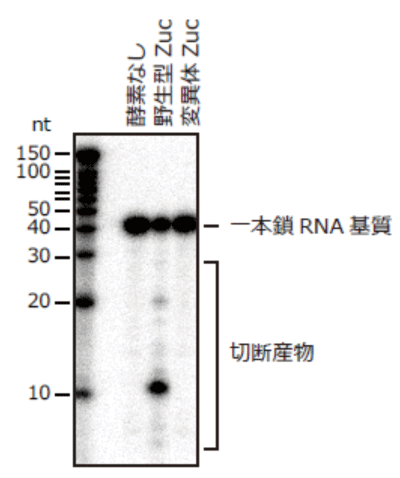
本研究グループは、ショウジョウバエのpiRNAの産生に関わるとされるいくつかのたんぱく質のうち、Zucたんぱく質の構造と機能を詳細に調べることにしました。まず、大腸菌を用いてショウジョウバエに由来するZucたんぱく質を大量に発現させ、高純度に精製し、結晶化することに成功しました。そして、大型放射光施設SPring-8のBL32XUの超高輝度マイクロビームを用いて微小なZucたんぱく質の結晶から高分解能のX線回折データを収集し、Zucたんぱく質の結晶構造を解明しました。その結果、Zucたんぱく質は1本のポリペプチド鎖からなる単量体が2つ集まった2量体を形成していることが分かり、2量体の界面に1本鎖RNAを切断するのに適した形の酵素活性部位を持つことが分かりました(図1)。さらに、これまでのGFP蛍光イメージングの結果と一致して、Zucたんぱく質はミトコンドリア外膜に局在して働くのに適した形をしていることが分かりました。次に、精製したZucたんぱく質の酵素としての働きを調べたところ、1本鎖RNAを切断する酵素活性を持つことが分かりました(図2)。Zucの酵素活性部位の形から予想されたように、2本鎖RNAを切断しませんでした。さらに、Zucたんぱく質の酵素活性部位を改変した変異体酵素を作製し、ショウジョウバエの生殖細胞に導入し、piRNAの産生やトランスポゾンの発現量を調べたところ、Zucたんぱく質のRNAを切断する働きはpiRNA産生とトランスポゾンの発現抑制の両方に必須であることが分かりました。
以上のように、X線結晶構造解析から予想されるZucたんぱく質の働きが、生化学的および細胞生物学的な解析によるZucたんぱく質の働きと一致し、Zucたんぱく質は1本鎖RNAからpiRNAを産生する仕組みに必要不可欠なRNA切断酵素であることが示唆されました(図3)。
今後の展開
これまでの研究により、Zucたんぱく質を含む複数のたんぱく質がpiRNA産生に重要であることは分かっていましたが、個々のたんぱく質の機能はほとんど不明でした。本研究によってZucたんぱく質の機能が明らかとなり、piRNA産生の分子機構の一端が解明されました。今後、ほかのたんぱく質の詳細な機能を明らかにしていくことで、トランスポゾン抑制機構が解明されることが期待されます。さらに、トランスポゾンによる遺伝子変異の抑制に関わるたんぱく質の異常は、ショウジョウバエやマウスの研究から不妊につながることが分かっています。今後、ヒトのトランスポゾン抑制に関わるたんぱく質についても同様に研究が進むことによって、ヒトにおける不妊発症機構の解明、さらにはその不妊治療への応用につながることが期待されます。
付記
本研究の成果の一部は、文部科学省ターゲットタンパク研究プログラム(研究代表者:濡木 理、研究分担者:塩見 春彦)、科学研究費補助金の外部資金支援を受けて行われたものです。
《参考図》
(左図)リボンモデル。Zucは2量体を形成し、2量体界面に酵素活性部位を持つ。2つの単量体を緑色と黄緑色で示した。RNA結合にかかわる亜鉛結合ドメインを黄色で示し、亜鉛イオンを灰色の球で示した。ZucはN末端の膜貫通へリックスを介してミトコンドリア外膜に結合していると考えられる。
(右図)分子表面モデル。プラスに帯電した表面を青色で示し、マイナスに帯電した表面を赤色で示した。基質である1本鎖RNAは酵素活性部位の溝に結合し切断されると考えられる。1本鎖RNAを模式的にマゼンタ色の線で示した。酵素活性部位の溝の幅は狭いことから、2本鎖RNAは結合できないと考えられる。
精製したZucたんぱく質と放射性同位体により標識した合成RNAを混合し反応させたのちに、ポリアクリルアミドゲル電気泳動により解析した。野生型Zucは1本鎖RNAを切断したのに対して、酵素活性部位に変異を持つZucは1本鎖RNAを切断しなかった。
piRNAクラスターと呼ばれるゲノム領域からpiRNA前駆体が転写される。piRNA前駆体は何らかのRNaseによって切断され、数百塩基長のpiRNA中間体が産生される。piRNA中間体はさらにZucによって切断され、約30塩基長のpiRNAが産生される。Yb bodyと呼ばれる顆粒構造体中において、Armiたんぱく質やYbたんぱく質の働きにより、Piwiたんぱく質注4)にpiRNAが組み込まれる。Piwi-piRNA複合体は核に移行し、トランスポゾンの発現を抑える。
《用語解説》
*1 トランスポゾン
真核生物のゲノムに存在する転移因子。動く遺伝子とも呼ばれる。トランスポゾンの転移は遺伝情報を破壊する可能性を持つ一方で、生物進化に寄与したとも考えられている。
*2 piRNA
生殖細胞に発現する約30塩基長のRNA。piRNAはたんぱく質の設計図として働かないRNA(非コードRNA)で、その多くはトランスポゾンに相補的な配列をもち、PIWIたんぱく質と結合しトランスポゾンの発現を抑える機能を持つ。
*3 ズッキーニ(Zuc)たんぱく質
ズッキーニ遺伝子はもともと、雌不妊の原因遺伝子としてショウジョウバエの遺伝学的スクリーニングにより同定された。その後の研究により、ズッキーニたんぱく質はpiRNAの産生に関わることが示されていたが、その機能はよく分かっていなかった、ズッキーニ遺伝子に変異を持つショウジョウバエの卵が野菜のズッキーニのような伸びた形態をとることから命名された。
*4 PIWIたんぱく質
piRNAと結合しトランスポゾンの発現を抑える機能を持つたんぱく質。動物は複数のPIWIたんぱく質を持ち、例えば、ショウジョウバエは3種類のPIWIたんぱく質(Piwi、Aub、Ago3)を持つ。Piwi遺伝子はもともと、生殖幹細胞の形成維持に必須な遺伝子としてショウジョウバエの遺伝学的スクリーニングにより同定された。Piwi遺伝子の変異は生殖機能不全を引き起こすことから、Piwi(P-element induced wimpy testis)と命名された。
|
《問い合わせ先》
東京大学 大学院理学研究科 生物化学専攻 (JSTの事業に関すること) (報道に関すること) (SPring-8に関すること) |
- 現在の記事
- ゲノムを変異から守る小さなRNAが作られる仕組みを解明(プレスリリース)