カルシウムポンプのマグネシウムイオンとサルコリピンによる調節機構のX線結晶解析による解明(プレスリリース)
- 公開日
- 2013年03月04日
- BL41XU(構造生物学I)
2013年3月4日
東京大学
発表のポイント
• どのような成果を出したのか:カルシウムポンプ蛋白質がカルシウムイオンを結合する直前の構造をX線結晶解析によって決定した。
• 新規性:「カルシウムポンプ蛋白質の作動機構の原子構造による解明」の最大の難関の一つを突破。マグネシウムイオンと調節蛋白質であるサルコリピンの結合様式を解明。
• 社会的意義/将来の展望:カルシウムポンプとサルコリピンは筋肉由来の熱発生に重要。サルコリピンの欠如は低体温症と体脂肪の増加を引き起こすとされる。創薬の標的だが困難であった哺乳類の大型膜蛋白質の大量生産と結晶化に成功。
|
東京大学分子細胞生物学研究所 豊島 近教授グループは、カルシウムポンプ蛋白質1)がカルシウムイオンを結合する直前の構造を、大型放射光施設SPring-8を用いたX線結晶解析によって決定した。この状態は豊島教授が追求してきた「カルシウムポンプ蛋白質の作動機構の原子構造による解明」2)の最大の難関の一つであった。細胞中に大量に存在するマグネシウムイオンが、カルシウム結合に向けてポンプ蛋白質を準備する様子が解明された。また、結晶構造中にカルシウムポンプの調節蛋白質として知られるサルコリピン3)が同定され、この状態を安定にしていることがわかった。サルコリピンは筋肉由来の熱発生と脂肪の燃焼に重要であり、類縁蛋白質であるフォスフォランバン4)とともに心筋の収縮制御にも深く関わっていることが知られている。そのため、創薬の標的となる蛋白質である。本研究では、また、これまで大変困難であり、創薬の大きな妨げとなっていた哺乳類の大型膜蛋白質5)の大量生産・精製の新手法を開発し、結晶化に成功したことも特筆される。この手法を用いることによって創薬のために重要な哺乳類の大型膜蛋白質の研究が著しく促進されることが期待できる。 (論文) |
東京大学分子細胞生物学研究所・豊島 近教授の研究グループ(岩澤志穂 学術支援職員、小川治夫 准教授、平田絢美 学術支援職員、杖田淳子 技術職員、ジュゼッペ・イネシ 博士)は、SPring-8を用いたX線結晶解析によって、カルシウムポンプ蛋白質がカルシウムイオンを結合する直前の構造を決定した。
カルシウムポンプはATP(アデノシン三燐酸)6)の化学エネルギーを利用して、濃度勾配に逆らって、カルシウムイオンを輸送する、約1000個のアミノ酸から成る大型の膜蛋白質(生体膜中に埋まって存在する蛋白質)である。ヒトは1日に体重と同程度の重量のATPを消費するが、その1/4以上はイオンポンプ蛋白質7)が消費するとされる。その中で、最も研究が進んでいるのがカルシウムポンプ蛋白質である。ここで用いられたカルシウムポンプ蛋白質は、筋小胞体8)とよばれる筋肉中のカルシウムの貯蔵庫の膜上に存在し、筋肉の収縮に当たって放出されたカルシウムイオンを再び筋小胞体中に取り込み、筋肉を弛緩させる重要な働きをする。豊島教授による2000年に発表された最初の結晶構造以来、反応サイクル中の大部分の中間体に関して結晶構造が決定され、カルシウムポンプのおおよその作動機構は原子構造から理解されるに到っている。2004年以来、豊島教授グループとデンマークグループとの間で熾烈な競争が続いている。
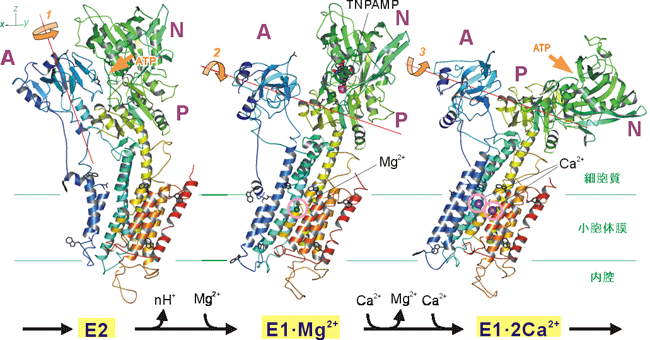
今回の構造研究によって、細胞中にカルシウムよりはるかに大量(千~一万倍)に存在するマグネシウムイオンが、運搬するカルシウムイオンの結合に向けてポンプ蛋白質を準備する様子が解明された。これまでは、カルシウムを運搬し終わった直後の構造(カルシウムに対して低親和性の構造、E2と表記される)と運搬する2個のカルシウムイオンを結合し終わった後の構造(E1・2Ca2+と表記される)のみが解明されていた。本研究によって、分子機械であるカルシウムポンプ蛋白質が、カルシウムに対して低親和性の構造(E2)から、どのようにしてカルシウム結合部位を高親和性(E1)に変化させ、次のカルシウムイオンの運搬に備えるかが解明された。この状態は豊島教授が追究してきた「カルシウムポンプ蛋白質の作動機構の原子構造による解明」における最大の難関の一つであった。
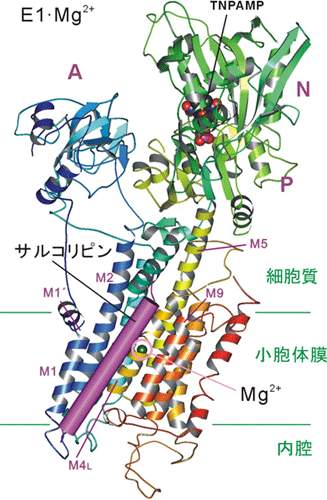
また、予想外の発見として、カルシウムポンプの調節蛋白質として知られるサルコリピンが結合しており、この状態を安定にしていることがわかった。サルコリピンは筋肉由来の熱発生と脂肪の燃焼に重要であり、サルコリピンの欠如は低体温症と体脂肪の増加を引き起こす可能性があると報告されている。また、サルコリピンは類縁蛋白質であるフォスフォランバンとともに心臓の収縮制御にも深く関わっていることが以前から知られていた。そのため、フォスフォランバンは心臓疾患に関する創薬の標的となってきたが、一方でサルコリピンに関しては不明な点が多かったため、創薬研究が進んでいなかった。しかし、今回サルコリピンとカルシウムポンプの結合様式が明らかになったことで、今後、肥満との関連でも創薬に向けた取り組みが進むであろう。
さらに、本研究では、これまで大変困難であり、創薬の大きな妨げとなっていた高等動物の大型膜蛋白質の大量生産・精製の新手法を生み出し、結晶化にも成功したことが特筆される。これによって創薬のために重要な、哺乳類の大型膜蛋白質の研究が大きく著しく促進されることが期待できる。実際、豊島研究室では、この手法を用いて、心筋のカルシウムポンプ蛋白質、マラリア原虫のポンプ蛋白質等の研究が進んでいる。
本研究は豊島教授を代表とする文科省科学研究費補助金・特別推進研究「薬剤開発を視野に入れた膜輸送体の構造研究」の一環として成されたものである。また、X線回折データ収集には大型放射光施設SPring-8の共用ビームラインBL41XUが使用された。
《参考図》
E2状態はカルシウムイオンを運搬し終わった後の状態であり、プロトンが結合しているため、カルシウムイオンに対し低親和性である。カルシウムに比べて1000倍以上多く存在するマグネシウムイオンを結合することによって、カルシウムイオンを強く結合できる状態を作り出す(E1・Mg2+)。その後に2個のカルシウムイオンが結合してマグネシウムイオンを追い出し(E1・2Ca2+)、それがATP結合サイトに伝わって燐酸化反応が起こる。
カルシウムポンプの調節蛋白質サルコリピンは膜貫通ヘリックスM2とM9の間の隙間に結合し、E1・Mg2+状態を安定化していることがわかった。
《用語解説》
1) カルシウムポンプ
ATP(アデノシン三燐酸)のエネルギーを使い、生体膜を隔てて濃度勾配に逆らってカルシウムイオンを運搬する大型の膜蛋白質。カルシウムの運搬は、カルシウムを結合する部位を、細胞内を向いておりカルシウムを強く結合できる状態(E1状態)から、反対側を向いてカルシウムを弱くしか結合できない状態(E2状態)に変化させることによって行われる。骨格筋では筋小胞体の膜蛋白質の半分以上を占め、ATPを大量に消費するため、体温維持のための熱源としての役割も注目されている。実際、深く潜る魚(メカジキ等)の発熱器官は熱発生のためにカルシウムポンプを使っていることが知られている。
2) 「カルシウムポンプ蛋白質の作動機構の原子構造による解明」
この研究によって2009年度の朝日賞が豊島教授に授与された。
3) サルコリピン
31個のアミノ酸残基からなる膜蛋白質。主に骨格筋と心房の筋小胞体に存在し、カルシウムポンプを制御。筋肉由来の熱発生に重要な働きをし、体温維持に不可欠である。また、昨年秋にNature Medicineに発表された論文によると、マウスでの実験からは、サルコリピンは脂肪の燃焼に深く関わり、その減少は体脂肪の増大を引き起こす。また、高脂肪食を与えると代謝を上昇させるために骨格筋のサルコリピンの発現量が増大するとされる。今後、肥満との関連で創薬標的となる可能性がある。
4) フォスフォランバン
52個のアミノ酸残基からなる膜蛋白質。主に心室の筋小胞体に存在し、カルシウムポンプを制御。通常はカルシウムポンプの機能を抑制し、興奮時には抑制がはずれる。それによって、興奮時に筋肉が大きく収縮できるように「溜め」をつくる働きがある。心疾患治療の標的分子として注目されている。
5) 膜蛋白質
生体膜に存在する蛋白質の総称。特に、生体膜の表面に付着しているものを膜表在性蛋白質、内部に埋もれているものを膜内在性蛋白質と呼ぶ。イオンポンプは膜内在性蛋白質である。大量生産や結晶化が困難であることで有名である。特に、哺乳類の大型の膜蛋白質は、大腸菌などでは生産できず、蛋白質の機能を検証することすら困難である。今後の創薬の標的の半分以上は膜蛋白質であると言われるが、その大量生産が困難なことが研究の大きな妨げとなっていた。今回の研究では、COS細胞(アフリカミドリザルの腎臓由来の細胞)を用い、十分実用化可能なレベルで哺乳類大型膜蛋白質を大量生産することに成功している。
6) ATP(アデノシン三燐酸)
生体のエネルギー通貨とよばれる物質。ATPがADPと燐酸にわかれるときに放出される化学エネルギーが、多くの生体反応のエネルギー源となる。筋肉の収縮もATPをエネルギー源とする。
7) イオンポンプ
細胞の中と外ではナトリウムやカリウム、カルシウムなどのイオンの濃度は異なっており、その濃度の違いを生体は信号伝達や、エネルギー源として他の蛋白質を動かす為に用いている。その濃度差を維持するのがイオンポンプであり、生体膜中に存在する膜蛋白質である。濃度勾配に逆らってイオンを輸送するため、エネルギー源が必要であり、ATPの化学エネルギーや光のエネルギー等が用いられる。
8) 筋小胞体
筋細胞にあって筋原繊維をとりかこむように存在する袋状の構造。カルシウムイオンの貯蔵庫である。筋収縮は筋小胞体中に貯えられたカルシウムイオンが放出されることによって収縮が開始され、カルシウムポンプによって筋小胞体中に汲み戻されることによって弛緩する。
9) 東京大学分子細胞生物学研究所 高難度蛋白質立体構造解析センター
2010年に設立。創薬の重要なターゲットの大半が膜蛋白質であるにも関わらず、膜蛋白質の立体構造登録数は全登録数の0.36% に過ぎないという現実をふまえ、薬剤のターゲットになるような膜蛋白質を積極的に取り上げて創薬へのブレークスルーを目指している。
|
《問い合わせ先》 (SPring-8に関すること) |
- 現在の記事
- カルシウムポンプのマグネシウムイオンとサルコリピンによる調節機構のX線結晶解析による解明(プレスリリース)