発見から50年、酸素添加酵素「ジオキシゲナーゼ」の反応機構が明らかに(プレスリリース)
- 公開日
- 2006年02月14日
- BL44B2(理研 物質科学)
平成18年2月14日
独立行政法人理化学研究所
|
独立行政法人理化学研究所(野依良治理事長)は、空気中の酸素分子を必須アミノ酸※1であるトリプトファン※2に取り込む反応(ジオキシゲナーゼ反応)を触媒する酵素の立体構造解析に成功し、この反応のメカニズムを明らかにしました。同反応を触媒する酵素「インドールアミン2,3-ジオキシゲナーゼ」※3の立体構造を明らかにしたもので、日本人が初めてこの反応を発見して以来、謎のままになっていた反応メカニズムが50年を経て、また日本の研究者によって解かれたことになります。これは、播磨研究所放射光科学研究センター城生体金属科学研究室の杉本宏研究員、城宜嗣主任研究員らの研究グループによる研究成果です。 (論文) |
1.背 景
呼吸によって体内に吸い込まれた酸素は、二つの役割を持っていることが知られています。一つは、生体に必要なエネルギーを生産することで、もう一つは、様々な物質に取り込まれて別の有用な物質をつくり出すことです。後者は「酸素添加酵素」の触媒作用の働きによります。
今から50年前、生物における酸化(生体酸化)※6は、「分子状酸素が加わるのではなく、水分子の酸素原子が加わって水素がとれる(脱水素)」というのが、1927年にノーベル化学賞を受賞した大学者H.O.ウィーラント以来の定説でした。早石博士は、空気中の酸素分子をトリプトファンに取り込んでいる酵素があることを発見し、これを「酸素添加酵素(オキシゲナーゼ)」と名付け、トリプトファンの代謝経路を明らかにしました。つまり、生体酸化には脱水素酵素による脱水素反応の他に、酸素添加酵素によって触媒される酸素添加反応があることを発見したことになります。この発見は、それまでの教科書を書き変える大発見となりました。
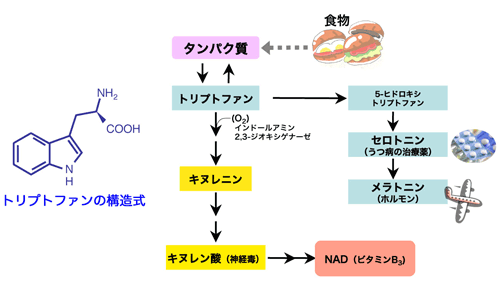
現在でもオキシゲナーゼは、生化学分野では極めて重要な酵素として位置付けられており、今年、酵素発見から50周年で、発見50周年記念の学会が二つ日本で開催されるほどです。その後、この種類の酵素がいくつか発見され、人間をはじめ、動物、植物、微生物に広く分布し、アミノ酸、ビタミン、脂質、ホルモン類、薬物や毒物の代謝に重要な役割を果たしていることが明らかになってきました(図1)。しかし、ヒトの「インドールアミン2,3-ジオキシゲナーゼ」のような、二つの酸素原子を取り込ませることが可能で、鉄を含んだヘムを補因子として持っているタイプの酸素添加酵素であるジオキシゲナーゼに関しては、半世紀もの間、その分子構造が明らかにされることはありませんでした。二つの酸素原子を取り込むということは、分子状酸素を取り込むことと同じことであり、ジオキシゲナーゼの構造がわからないために、トリプトファンの中に分子状の酸素がどのような分子機構で取り込まれるのかは謎のままでした。
2.研究手法
研究グループは、X線結晶構造解析法※7を用いて、インドールアミン2,3-ジオキシゲナーゼの構造解析に取り組みました。まず、遺伝子工学の手法を用いて、ヒトの遺伝子を大腸菌内に組み込みインドールアミン2,3-ジオキシゲナーゼのタンパク質サンプルを大量に調製し、良質な結晶を得ることに成功しました。その結晶を、大型放射光施設(SPring-8)の理研構造生物学IIビームラインBL44B2や構造ゲノムIビームラインBL26B1の放射光にあて、2.3オングストローム※8(Å=10-10メートル)分解能のX線回折データを収集し、世界で初めてこの酵素の構造解析に成功しました。さらに、酵素内のアミノ酸に変異を加えたサンプルも調製し、その変異によってもたらされる酵素の働きの変化について、解析を行いました。9
3.研究成果
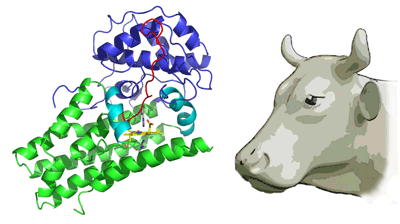
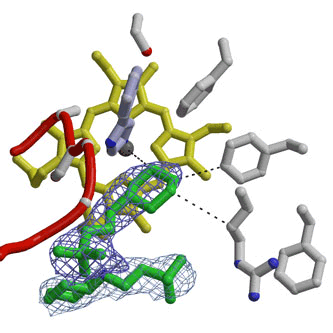
この酵素の活性部位に阻害剤が結合した状態の立体構造を解析した結果、酵素は牛の頭の形によく似た立体構造であることが明らかになりました(図2)。これまでは、反応の開始には、酵素のくぼみの中で酵素の極性アミノ酸側鎖がトリプトファンから水素原子を引き抜くステップが必要であると考えられていました。しかし、今回の解析結果では、酵素に結合したトリプトファンと補因子のヘムに結合した酸素分子とが、直接相互作用することで反応が開始し、その結果、二つの酸素原子が添加されるという反応機構が明らかとなりました。このような機構は、ほかの酵素では全く例のないものです。また、ループ構造が関与するトリプトファンの酵素への結合様式も独自のものでした(図3)。
インドールアミン2,3-ジオキシゲナーゼが持っている独自の触媒反応と、その反応機構を可能にしている構造を理解できたことは、トリプトファンにどのように酸素が取り込まれるのかという、50年越しの謎が解けたことを意味するだけでなく、この反応を化学工業や医薬品開発のツールとして有効利用するための道が開けたことになります。
4.今後の期待
今回、同研究グループの立体構造解析によって、酵素の働きによるトリプトファンと分子状酸素の反応機構を、原子レベルで解明することができました。この酵素によって分解されるトリプトファンは、必須アミノ酸としてタンパク質の部品となるほか、メラトニン(ホルモンの一種)・セロトニン(神経伝達物質)・ビタミンBなどといった、人体にとって必要不可欠な成分へと変換されています。また、10年ほど前から、トリプトファンの体内濃度によって、腫瘍やウイルスの増殖がコントロールされることが判明してきています。したがって、解析された立体構造と反応機構をもとに、この酵素の体内での働きをうまく制御するような薬剤が開発できると、脳障害・加齢性白内障・がん・ウイルス感染に対する治療法開発に貢献すると期待されます。
<参考資料>
食物を通して体内に取り入れたトリプトファンは体の中で様々な活性物質の素となっている。このような変換は酵素の働きで行われており、「インドールアミン2,3-ジオキシゲナーゼ」はその一つである。
青色と緑色の2つのドメインから成り立っており、その間には酵素活性に必要な補因子である黄色で示したヘムがはまり込んでいる。赤いループで示したループ構造部分も酵素の働きにおいて重要だと考えられる。
黄色で描かれているのがヘム分子、赤がタンパク質の主鎖の一部(ループ構造)、白はアミノ酸側鎖、緑色は基質をまねて結合している化合物、青いかごは電子密度の一部分。
<用語解説>
- ※1 必須アミノ酸
アミノ酸には多くの種類があるが、人間が生きていく上で必要なアミノ酸は20種類と言われている。そのうち8種類は人間の体内で合成できず、食品等から摂取しなければならないので、「必須アミノ酸」と呼ばれている。
- ※2 トリプトファン
アミノ酸の一種で、精神安定剤として利用されている神経伝達物質であるセロトニン、規則的な睡眠を助けるホルモンであるメラトニン、ナイアシン(ビタミンB3)をつくる材料となる。ダイエット剤、血圧をコントロールする働きや脳の障害(行動障害など)の治療薬としても利用されている。また、体内のトリプトファンの濃度によって腫瘍細胞やウイルスの増殖が制御されているという報告が近年注目されている。
- ※3 インドールアミン2,3-ジオキシゲナーゼ
哺乳類が持つトリプトファン分解酵素。アンモニアの水素原子のひとつがインドールと呼ばれる分子を含む炭化水素基で置換された化合物をインドールアミンという。トリプトファン、セロトニン、メラトニンはインドールアミンの一種である。
- ※4 ヘム
ポルフィリンという有機物の環に鉄イオンが配位したもので、ポルフィリン環に結合する種類や結合位置で多くの種類に分類される。ヘムを分子中に取り込んではじめてその機能が発揮されるタンパク質をヘムタンパク質と呼び、通常赤い色をしている。酸素運搬体であるヘモグロビン、ミオグロビン、電子伝達に関与するシトクロム類、酵素作用をもつペルオキシダーゼなどがヘムタンパク質の代表例。
- ※5 補因子
酵素の反応を担う補助的な役割を持ったもの。補因子は配合団、補酵素、金属などに分類され、ヘムは配合団に属す。
※6 生物における酸化・生体酸化
物質に酸素が化合する反応、あるいは、物質が水素を奪われる反応などを酸化と呼ぶ。生体内においては、酸素を使用し食物からエネルギーを取り出す反応のことも呼ぶ。
- ※7 X線結晶構造解析
波長の短いX線を物質が規則正しく並んだ結晶に照射し、回折されたX線の強度を詳しく解析することにより、結晶内の分子構造を解明することができる。X線結晶構造解析法の登場によって、非常に多くのタンパク質構造が決定されている。
- ※8 オングストローム(Å)
長さの単位で、1オングストロームは1x10−10メートル(= 0.1ナノメートル)。タンパク質の立体構造解析では、解析した構造の分解能を表す単位として用いられ、数字が小さいほどより精度の高い高解像度の立体構造であることを意味する。
|
<本研究に関する問い合わせ先> 播磨研究推進部 (報道担当) <SPring-8についての問い合わせ先> |
- 現在の記事
- 発見から50年、酸素添加酵素「ジオキシゲナーゼ」の反応機構が明らかに(プレスリリース)