タンパク質の折り畳み過程をリアルタイムで観測 (プレスリリース)
- 公開日
- 2004年01月29日
- BL45XU(理研 構造生物学I)
平成16年1月29日
独立行政法人理化学研究所
|
独立行政法人理化学研究所(野依良治理事長)は、アポミオグロビン※1とよばれるタンパク質が変性した状態から折り畳む過程を、X線小角散乱法を使ってリアルタイムで観測しました。京都大学大学院工学研究科の鵜澤尊規大学院生(博士課程)、高橋聡助手(現:大阪大学蛋白質研究所)、理研播磨研究所構造生物化学研究室の藤澤哲郎先任研究員らによる研究成果です。 (原題) |
1.背 景
タンパク質は、アミノ酸がひも状につながった高分子であり、アミノ酸の並び方(配列)に従って特定の形に折り畳まれ、生体中でその機能を発揮します。しかし、「あるアミノ酸配列を持つタンパク質はなぜ特定の形に折り畳まれるのか?」という問題はいまだに解かれていません。これはタンパク質の折り畳み問題と呼ばれますが、この問題を解くことで、アミノ酸配列をもとにしたタンパク質構造の予測や人工タンパク質の設計など、多くの応用が可能になると想像されます。
タンパク質の折り畳み問題が難しい理由は、タンパク質構造の自由度が天文学的に大きいことです。そのため、最新の計算機を使っても、折り畳み構造を選び出すことはできません。一方で、実際のタンパク質は、数マイクロ秒から数十秒という短時間で折り畳まれる性質を持ちます。現実のタンパク質の折り畳み過程には、単なる大規模計算ではわからない秘密が隠されていると思われます。
研究グループでは、タンパク質の折り畳まれる過程を実験的に観察することを目的に研究を続けています。タンパク質の構造を特徴づける最も大切な量はコンパクトさです。そのため、タンパク質の折り畳まれる過程で、いつどの程度コンパクトになったかを知ることは大変重要ですが、この情報を得ることは、これまでほとんど不可能でした。我々は、X線小角散乱(SAXS)を使うことで、この情報を得ることに挑みました。
SAXSは、溶液中のタンパク質のコンパクトさをX線の散乱から高速で測定できるほぼ唯一の手法ですが、測定には輝度が高いX線源などの特別の施設が必要でした。SPring-8のビームライン(BL45XU)は、生体分子のSAXSを測定するために整備されたユニークな施設です。我々は、このビームラインを利用し、2液を混合して200マイクロメートル幅の細い流路に連続して流すことによって時分割SAXSを観察する装置を開発しました(図1)。この装置により、100マイクロ秒の時間分解能※3を達成しましたが、これは、世界で我々だけが持つ実験技術です。
本研究ではアポミオグロビン(apoMb)と呼ばれるタンパク質を取り上げ、折り畳み過程を観察しました。apoMbは7本のヘリックス※4(コイル状の構造)から構成される構造を持ちます(図2)。本研究では、酸性溶液中で変性したapoMbを中性の溶液中に高速に溶かし込むことで折り畳みを開始し、その後の構造変化をSAXSで観察しました。
2.研究成果と意義
我々の観測したapoMbの折り畳み過程を図3に示します。この図は、横軸がapoMbの回転半径、縦軸はapoMbを構成するアミノ酸の中でヘリックス構造を持つ割合(ヘリックス含量)に対応します。回転半径の値は時分割SAXS測定から、ヘリックス含量は同時に行われた別の測定から得ました。この結果は、ヘリックス含量が少なくRgが大きい変性apoMb(変性状態)が、折り畳み開始後300マイクロ秒以内に収縮した状態(中間体 I)に変化し、さらに、約5msの時定数で次の状態(中間体 II)を作った後に、約50msで最終的な折り畳み状態が作られることを世界で始めて示しました。
以上の観察で、我々が最も驚いたのは、折り畳み開始後300マイクロ秒以内という短時間で、apoMbが大規模な収縮を示したことです。得られたSAXSデータをさらに解析することで、apoMbに含まれる原子の80%以上がこの収縮に関わることもわかりました。これは、apoMbが、最初の過程で収縮することで、折り畳み構造を探すための自由度を大幅に制約することを示唆します。そのため、我々は“収縮と探索”collapse and searchという折り畳み運動を提案しました。これは、apoMbを代表とするヘリックスの多いタンパク質の折り畳みについて、一般に成り立つ運動ではないかと考えています。
3.今後の期待
今回の結果は、タンパク質の折り畳み過程を計算で再現する際のベンチマーク(指標)になると思われます。また、開発した手法を使って、構造の異なる他のタンパク質の折り畳み過程を調べ、折り畳み過程と構造の関係を考察することで、タンパク質の形を決める要素は何かという問題を解く手がかりが得られるだろうと期待しています。
この研究は、京都大学と理化学研究所の共同研究として行われました。研究には、文部科学省の科学研究費補助金、科学技術振興調整費のほか、科学技術振興機構の「さきがけ研究21」の支援などを受けました。
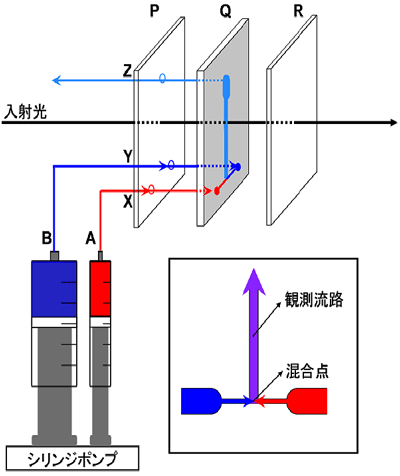 図1 高速液体混合装置の概要 |
|
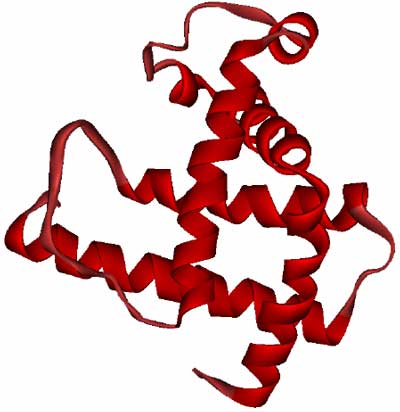 図2 アポミオグロビンのリボンモデル図 |
|
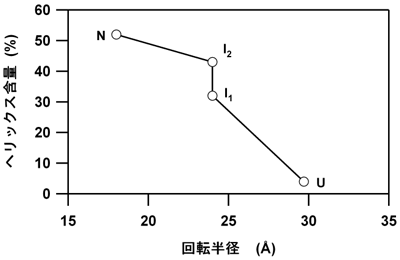 図3 アポミオグロビンの折れ畳み過程
|
<補足説明>
- ※1 アポミオグロビン
酸素分子を貯蔵する働きを持つミオグロビンから、ヘムとよばれる補欠分子族を取り除いたタンパク質。
- ※2 時分割X線小角散乱法
X線小角散乱法を使って、タンパク質の“姿”の時間変化を調べる手法。X線小角散乱とは、ナノスケールの構造を反映した、数度程度の小さな散乱角に現れるX線の散乱のこと。
- ※3 時間分解能
時間的に近接して起こる、2つの現象の時間間隔を測定できる能力のこと。測定手段の時間精度を表す。
- ※4 へリックス
タンパク質のとる高次構造の1つ。アミノ酸3.6残基で1回転するらせん形構造で、1残基あたり1.5Åのすすみをもつ。
|
<本件に関する問い合わせ先> 大阪大学・蛋白質研究所・蛋白質溶液学研究部門 (報道担当) <SPring-8についての問い合わせ先> |
- 現在の記事
- タンパク質の折り畳み過程をリアルタイムで観測 (プレスリリース)