細胞質から核内へのタンパク質輸送 - 核内輸送受容体の構造解析で輸送メカニズムを解明 - (プレスリリース)
- 公開日
- 2007年10月12日
- BL41XU(構造生物学I)
平成19年10月12日
公立大学法人横浜市立大学
独立行政法人理化学研究所
財団法人高輝度光科学研究センター
|
本研究成果のポイント 全体の概要 (論文) |
背景:
最近の分子生物学の進歩により、生物学の基本的な問題である発生・分化・免疫・老化・神経に関する様々な遺伝子(DNA)が同定されてきました。高等動植物の細胞の核内では、DNAの複製や転写・修復・組換・修飾、あるいはDNAに結合したヒストンの化学修飾などといった生命の維持や活動に必要な数多くのタンパク質が働いており、これらのタンパク質に異常がおこると様々な疾患の原因になります。しかしながら、すべてのタンパク質は細胞質で合成されますので、核内で働くタンパク質は細胞質から核膜を通って核内へ輸送される必要があります。
このような核-細胞質間の物質輸送は核膜孔複合体※3を介して行われます。分子量60,000以上の巨大分子(タンパク質分子など)は単独では核膜孔複合体の小孔を通過できず、核内へは移行できません。このような巨大分子は核内輸送受容体と呼ばれるタンパク質と結合し、核膜孔複合体と複雑に相互作用しながら核内へと輸送されていきます。このような核内輸送受容体の一つにトランスポーチンが挙げられます。トランスポーチンは輸送されるタンパク質の核局在化ペプチド(荷札)を認識して様々なタンパク質を核内に輸送し、核内においては RanGTP※4と結合して輸送タンパク質を切り離します(図1)。しかしながら、核内に輸送されるタンパク質の核局在化ペプチドには配列相同性がほとんどなく、核内に輸送されるタンパク質が細胞質で核内輸送受容体にどのように認識され、核内でどのように切り離されるかについては、これまで実験的に明らかにされていませんでした。
研究の手法と成果:
・トランスポーチンは20個のHEATリピート(H1-H20)から構成されたS字状分子で、HEATリピート8からディスオーダーした長いループ(H8ループ)が伸びている(図2のA-D)。
・輸送するタンパク質の核局在化ペプチドはHEATリピート8から18(H8-H18)に結合する。このうち、H8からH13(サイトA)とH14からH18(サイトB)ではトランスポーチンに対する親和性が異なる(図2のFおよび図3)。
・トランスポーチンの構造はサイトBでの核局在化ペプチドとの親和性によって大きく変化する(図2のF および図3)。
さらに、核内輸送受容体と輸送タンパク質の核局在化ペプチドとの相互作用を変異体を用いたGSTプルダウンアッセイ※6及び表面プラズモン共鳴法※7で解析し、
・hnRNP Dの核局在化ペプチドはサイトAとサイトBの両方で相互作用し、TAP及びJKTBPの核局在化ペプチドはサイトAのみで相互作用する。 そして、トランスポーチンと核内輸送タンパク質との相互作用の多様性はサイトBでの相互作用の大小によって規定される (図3)。
・細胞質から核内へのタンパク質輸送は、核局在化ペプチドが細胞質でサイトAとサイトBの両方でトランスポーチンに認識される機構(図4のA)とサイトAのみで認識される機構(図4のB)の2つの機構が存在し、どちらの機構が選択されるかはサイトBでの相互作用の有無によって決まる。
ことなどを明らかにしました。
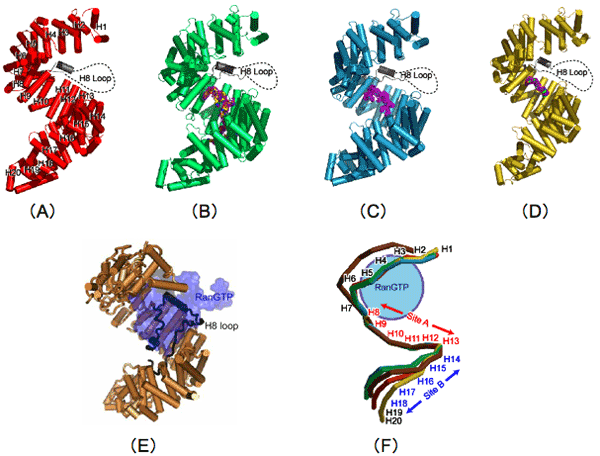 図2 ヒト由来のトランスポーチンの立体構造。
図2 ヒト由来のトランスポーチンの立体構造。HEATリピートを形成しているαへリックスは円筒で、H8ループのディスオーダー領域は破線で表示されている。
| (A)トランスポーチン単体。 |
| (B)トランスポーチンとhnRNP D核局在ペプチドとの複合体。 |
| (C)トランスポーチンとTAP核局在ペプチドとの複合体。 |
| (D)トランスポーチンとJKTBP核局在ペプチドとの複合体。 |
| (E)トランスポーチンとRanGTPとの複合体(Chook & Blobel, 1999)。 |
| (F)上記(A)から(E)のトランスポーチン部分の構造比較。 |
直線の色は上記(A)から(E)の色と一致しています。
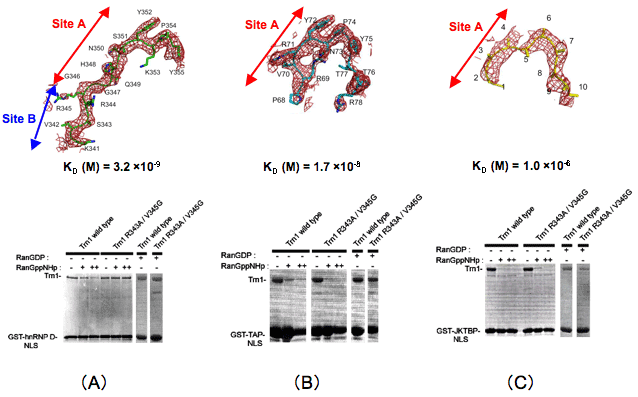 図3 トランスポーチンに結合している核局在ペプチドの電子密度(上)とGST-プルダウンアッセイ(下)。
図3 トランスポーチンに結合している核局在ペプチドの電子密度(上)とGST-プルダウンアッセイ(下)。トランスポーチンと核局在ペプチドの解離定数KD、及び、サイトA及びサイトBに結合する核局在ペプチドの領域も合わせて表示しています。
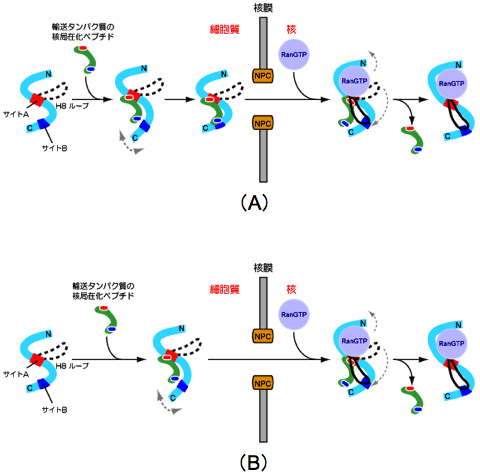 図4 核内輸送受容体による細胞質から核内へのタンパク質の輸送機構。
図4 核内輸送受容体による細胞質から核内へのタンパク質の輸送機構。サイトAとサイトBの両方で相互作用するhnRNP Dは(A)の機構で、サイトAのみで相互作用するTAP及びJKTBPは(B)の機構で核内に輸送されます。
今後の展望:
細胞は常に外部から様々な刺激(ストレス、光、乾燥など)を受けています。このような刺激はシグナルとなって細胞質から核内へと伝達され、DNAの複製・転写・修復・組換・修飾やヒストンの修飾などの働きが調節されています。したがって、核-細胞質間の物質輸送を含む情報交換を統合的に解析することができれば「様々な細胞外からの刺激に対する応答」という基本的な生命維持機構の研究に新たな局面を与え、細胞機能を包括的に理解できるようになるものと期待されます。
また、核内に輸送されるタンパク質は、DNAの複製・転写・修復・組換・修飾やヒストン修飾などに関与する重要なタンパク質ばかりです。したがって、核-細胞質間の物質輸送の異常は様々な疾患(ガンや糖尿病、神経疾患、神経疾患、免疫性疾患など)に関わる可能性があります。例えば、「細胞外からのストレスに対する応答」に関係する神経疾患については、細胞外からのストレスが核内に正しく伝達されないためにストレス感受性の神経細胞の働きが低下するなど、核-細胞質間のタンパク質輸送の理解が疾患の病因病態解明に新たな展開を与えることになるものと期待されます。
トランスポーチンは、今回の研究で取り上げあげた輸送タンパク質以外にも多くのタンパク質を核内に輸送していきます。核内で働くタンパク質であることを示す荷札の種類や大きさも様々です。したがって、今後は、さらに多くの核内輸送タンパク質についてトランスポーチンとの複合体のX線結晶構造解析や相互作用解析を行ない、核-細胞質間の物質輸送を核-細胞質間の情報交換へと展開させ、より統合的に解析していきたいと考えています。
<用語解説>
※1 DNAの修復
DNAは活性酸素などの内的要因や放射線、化学物質などの外的要因により絶えず損傷を受けています。DNAの修復はこのような様々な要因で起こるDNA分子の損傷を修復するプロセスです。DNA分子の損傷は、細胞の持つ遺伝情報の変化や損失をもたらすだけでなく、その構造を劇的に変化させてDNAにコード化されている遺伝情報の読み取りに重大な影響を与えます。
DNAの組換
DNAの(相同)組換は、互いに相同な二本鎖DNA 分子の間で互いに対応するDNA 部分を交換または置き換える現象です。これは,遺伝,進化の要に働く普遍的な遺伝現象で、農業生物等の育種や改良の主要な手段でもあります。
DNAの修飾
真核生物では一部の生物の例外を除いてゲノムDNAのシトシン塩基(C)の5位がメチル化修飾を受けます。一般に、転写されている遺伝子のプロモーター領域は低メチル化状態にあり、不活性な遺伝子は高度にメチル化されていますので、DNAがメチル化修飾されると転写が抑制されます。
※2 ヒストンの化学修飾
真核生物のDNAはヒストンと呼ばれるタンパク質と複合体を形成しています。この複合体の基本単位はヌクレオソーム・コアと呼ばれ、これが数珠状に繋がり、さらに幾重にも折れ畳まれて細胞の核内に存在しています。ヒストンのN末端領域はヌクレオソーム・コアから突き出し、アセチル化やメチル化、リン酸化など様々な化学修飾を受けます。このようなヒストンの化学修飾と脱修飾はクロマチンの構造を変化させ、発生や分化における遺伝子の発現調節、X染色体の不活化、ゲノムインプリンティング、ガンなどの疾病といった多くの生物現象に深く関与しています。ヒストン修飾に関する研究は近年盛んに行われ、アセチル化酵素やメチル化酵素、及び、それらの脱修飾酵素などヒストンの修飾・脱修飾に関与する分子が次々に同定されています。
※3 核膜孔複合体
真核生物の細胞では、核と細胞質の間で物質輸送が行われています。この物質輸送を媒介するのが核膜孔複合体(Nuclear Pore Complex)です。核膜孔複合体は細胞質と核を隔てる核膜中に存在し、その数は細胞あたり、酵母では100-200個、ヒトの細胞では2000-3000個です。脊椎動物の核膜孔複合体は細胞内で最も大型の生体超分子複合体の一つで、分子量は約125×106と見積もられ、50-100個のnucleoporinと呼ばれるタンパク質から構成されています。一方、酵母のNPCは小型で、分子量は約66×106と見積もられ、約30個のnucleoporinから構成されています。
※4 RanGTP
グアニンヌクレオチド(GTP、GDP)が結合したGタンパク質の一種。GTP及びGDPと結合することによって細胞外から細胞内へのシグナル伝達に関与する。Gタンパク質は、膜受容体のヘテロ三量体のGタンパク質(「大きな」Gタンパク質:分子量は100kDa前後)と「小さな」Gタンパク質(分子量が20から30kDa)に分けられる。RanGTPは後者の「小さな」Gタンパク質に属するRanというタンパク質にGTPが結合したものである。
※5 hnRNP D
核内に存在する不均一な長さをもつRNA(hnRNA)(mRNAの前駆体)に結合するタンパク質の一種。
TAP
Tip Associated Proteinの略で、Tyrosine kinase-interacting protein(Tip)とのtwo-hybridで同定されたタンパク質。
JKTBP
ヒトミエロペルオキシダーゼ遺伝子のイントロン9のシスエレメントJKT41に結合するタンパク質として同定されたhnRNP Dに類似したタンパク質。
※6 GST-プルダウンアッセイ
目的のタンパク質同士が結合するか in vitroで確かめるアッセイ。主にタンパク-タンパク間の結合領域を調べるのに用いられます。あるタンパク質XにGST(グルタチオン-S-トランスフェラーゼ)タグをつけて発現させ,つけたタグを用いてタンパク質Xをカラムに固定し、タンパク質Xと結合するタンパク質を検出する手法。
※7 表面プラズモン共鳴法
センサーチップ表面に試料(これをリガンドと呼ぶ)を固定し、リガンドと相互作用する試料(これをアナライトと呼ぶ)を含む溶液をセンサーチップ表面に流すとリガンドとアナライトが相互作用し、表面プラズモン共鳴シグナルが変化します。このシグナルの変化をリアルタイムで測定することによって、リガンドとアナライトの結合定数や解離定数を見積もることができます。
|
<問い合わせ先> (研究内容に関すること) (SPring-8の分析に関すること) (理化学研究所に関すること) (SPring-8全般に関すること) |
- 現在の記事
- 細胞質から核内へのタンパク質輸送 - 核内輸送受容体の構造解析で輸送メカニズムを解明 - (プレスリリース)
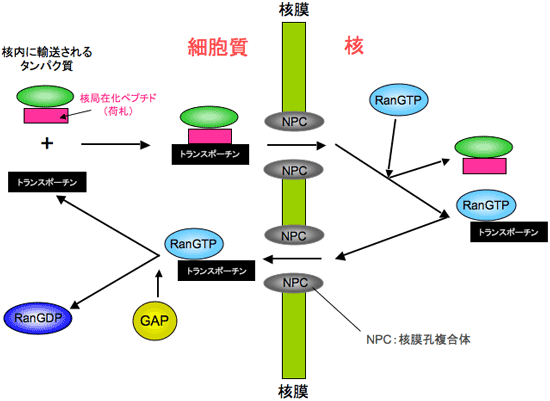 図1 核内輸送受容体トランスポーチンによる核-細胞質間のタンパク質輸送。
図1 核内輸送受容体トランスポーチンによる核-細胞質間のタンパク質輸送。