SPring-8放射光により解明された筋収縮蛋白ミオシンの意外な振舞(トピック)
- 公開日
- 2001年01月26日
- BL45XU(理研 構造生物学I)
平成13年1月26日
(財)高輝度光科学研究センタ-
通信総合研究所
理化学研究所
|
高輝度光科学研究センター(JASRI)の岩本裕之主幹研究員のグループは、郵政省(現総務省)通信総合研究所の大岩和弘室長と共同で、収縮蛋白ミオシンの振舞いをX線回折法により詳細に測定し、収縮状態のミオシンは分子全体がアクチン繊維(レールの役割をする蛋白)の上で激しく揺動していることを明らかにした。これは、定説とされるミオシンの振舞いとは大きく異なるものであった。本研究は世界最大の大型放射光施設(SPring-8)の理研構造生物学IビームラインBL45XUを用いて行われ、その成果は1月26日発行の学術雑誌「Journal of Molecular Biology」に掲載されてその表紙を飾った。 (論文) |
背景
筋細胞の中にはアクチン、ミオシンという2種の収縮蛋白があり、それぞれ多数の分子が集合して繊維を形成している(図1a)。収縮力は、この2種の繊維同士が互いに滑り合うことで生じる(図1b)。ミオシン分子は、ミオシン頭部と尾部の2つの部分に分けることができる(図1c)。ミオシン頭部はアクチンに結合し、またATPの持つ化学エネルギーを力学的エネルギーに変換する。ミオシン尾部は繊維の形成に関与する。最近(1993年)ミオシン頭部の立体構造が決定され、ミオシン頭部はさらにアクチン・ATP結合部位を持つ球状の「モータードメイン」と、棒状の「レバーアーム」という2つの部分に分けられることが明らかになった(図1d)。それ以来、モータードメインはアクチン分子にしっかり結合し、その上でレバーアームが首振り運動をすることで収縮力が発生すると考えられるようになった(図1e)。このモータードメインのアクチン分子に対する結合様式は「立体特異的結合」と呼ばれる。これはアクチン分子の向きが定まると、それに結合するモータードメインの向きも厳密に定まることを意味する。
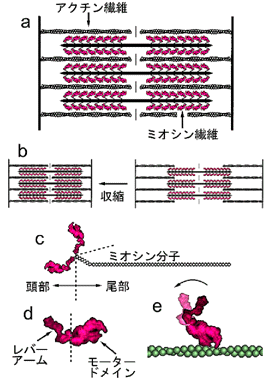
図1
実験結果
筋細胞を引き伸ばすと(図1b右)アクチン繊維が引き出されて、まわりにミオシンがない裸の状態になる。このようにした筋細胞にX線を当てると、図2aのような回折像が現れる。矢印で示したのはアクチンのらせん状配列に由来する層線反射であるが、強度は低く数も少ない。
この裸のアクチン繊維にミオシン頭部(蛋白分解酵素で尾部から切り離したもの)を外から加えてATPのない状態で結合させると、ミオシン頭部はアクチンのらせん状配列にしたがって立体特異的に強く結合する。このときの回折像は図2bのようで、多数の強い層線反射が出現する。
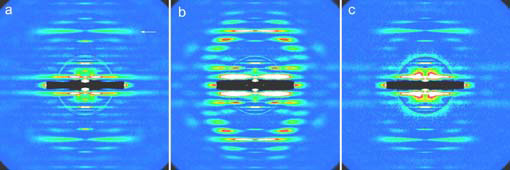
図2
これにATPを加えて、収縮中の状態にして得られた回折像が図2cである。ミオシン頭部がアクチンから外れないように架橋試薬で化学的に架橋してしまう。こうすると、ミオシン頭部はアクチンに結合したまま激しい勢いでATPを分解し、力発生のサイクルを繰り返す(ただし尾部が切断されているので力は伝達されない)。このとき、定説に従えば立体特異的結合ができているので、回折像は図2bに似たものになると予想される。しかし実際に記録された回折像(図2c)は裸のアクチン繊維に由来するもの(図2a)に酷似していて、立体特異的結合ができている形跡は全くなかった。そればかりか、ミオシン頭部全体がアクチン繊維上で激しく揺動するあまりアクチンのらせん周期に従う部分が全くないという状態でなければ、図2cの回折像は説明できない。
以上から、ミオシンによる力発生の仕組みは従来唱えられてきたレバーアーム説のような単純なものではなく、モータードメイン・アクチン間の動的相互作用も重要な役割を果たしている可能性が大きい。例えば、アクチンとモータードメインの接触面は不安定な状態にあり、そこに安定な立体特異的結合を形成しようとする力が張力発生の原動力になる (立体特異的結合が形成される前に次のATP分解サイクルが始まってしまうので、実際には立体特異的結合は検出できない)というのが1つの説明である。
本研究に関連した技術革新
SPring-8の強力なX線と最新の検出器(冷却CCDカメラ)組み合わせにより、従来に比較して露光時間が大幅に短縮された(1昼夜から1秒に)。しかしハードウェアの進歩だけでなく、実験手法についてもSPring-8放射光の特長である高エネルギー性にあわせて最適化した試料配置や化学架橋法の導入など、様々な改良がなされている。これらの技術や手法の組み合わせは、難聴などの遺伝疾患にも関係する非従来型ミオシンや、非筋細胞にも多種存在するアクチン結合蛋白の構造・機能解析等にも応用が可能で、広く放射光利用研究の促進に資するとともに各種疾患の発症機構の解明にも役立つと思われる。
本研究は、先端的共同利用施設利用促進事業(科学技術振興事業団)の一環として行われた。実質研究期間は2年2ヶ月である。
解説
らせん状に並んだ蛋白分子のX線回折像
アクチン繊維はアクチンの球状分子がらせん状に並んだものである。これのX線回折像は図3のようになり、繊維の軸に直角な多数の層状の線が左右対称に現れる。それぞれの層状の線は「層線反射」と呼ばれる。この中で、らせんの短周期のピッチ(59オングストローム)に相当する層線反射(矢印)は特に強い。
X線回折像中の長さは実際の物体の長さの逆数で表わされる。裸のアクチン繊維は直径が細いので、59オングストロームの層線反射の強度ピークは中心から離れた位置にある(図2a)。個々のアクチン分子にミオシン頭部が立体特異的に結合すると、ミオシン頭部はアクチンのらせん周期に従って並ぶ上に、繊維全体が太くなるので、層線反射は強くなり、その強度ピークは中心よりに移動する(図2b)。ATP存在下でミオシン頭部が活性化された状態では、層線反射の強度ピークは裸のアクチンの場合と全く同じ位置にある(図2c)。
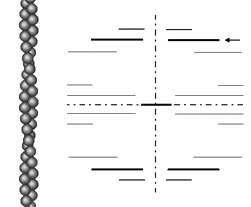
図3
本文書で用いられている図には版権が設定されていますので、無断掲載・転載はお断りいたします。
|
<本研究に関する問い合わせ先> <SPring-8についての問い合わせ先> |
- 現在の記事
- SPring-8放射光により解明された筋収縮蛋白ミオシンの意外な振舞(トピック)