ゲンジボタルの発光現象の仕組みをとらえる(プレスリリース)
- 公開日
- 2006年03月16日
- BL44B2(理研 物質科学)
- BL45XU(理研 構造生物学I)
平成18年3月16日
独立行政法人理化学研究所
本研究成果のポイント
● 発光酵素「ルシフェラーゼ」の反応過程の立体構造を世界で初めて決定
● 発光色を決定しているメカニズムも解明
● 高い発光効率の工業化も可能に
|
独立行政法人理化学研究所(野依良治理事長)は、国立大学法人京都大学と共同で、ホタルが黄緑色に光るメカニズムを世界で初めて原子レベルで解明することに成功しました。ホタルの発光に関わる酵素(タンパク質)「ルシフェラーゼ」※1をはじめとする生物発光に関与する物質はすでに知られていましたが、今回、大型放射光施設(SPring-8)の理研構造生物学ビームラインI(BL45XU)と理研構造生物学ビームラインII(BL44B2)を用いて、ルシフェラーゼの立体構造を解明し、さらに発光色を決定しているメカニズムを明らかにしました。この研究成果は、理研播磨研究所メンブレンダイナミクス研究グループの中津亨連携研究員(京都大学大学院薬学研究科助教授)、市山進連携研究員(学習院大学助手)、小橋信行連携研究員(現在は中央研究所吉田化学遺伝学研究室)、加藤博章チームリーダー(京都大学大学院薬学研究科教授)、京都大学化学研究所平竹潤助教授らの研究グループによるものです。 (論文) |
1.背 景
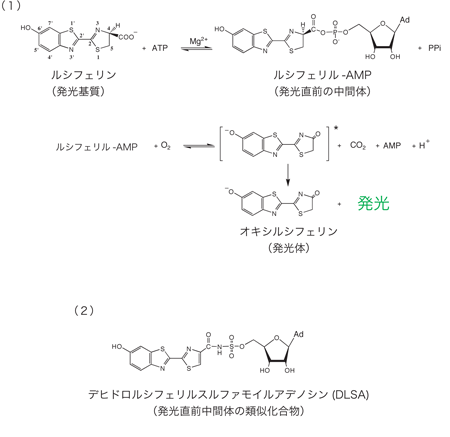
初夏になると、ホタルは互いのコミュニケーションのために黄緑色の光を放ち明滅します。このホタルの発光は、タンパク質であるルシフェラーゼ(酵素)と発光のもととなる物質ルシフェリン(発光基質)が反応することにより生じます。最初にルシフェリンがルシフェラーゼの中でATP※4と反応し、発光する直前の中間体化合物を生成します。次にこの化合物が酸化されることで、エネルギーを持った「オキシルシフェリン」という発光体が生成され、そのエネルギーを放出する際に発光します(図1)。ホタルのルシフェラーゼの立体構造は、アメリカ産ホタルのルシフェラーゼでは1996年にすでに明らかになっていました。しかし、この時点で明らかにされた立体構造は、反応に関わるルシフェリンなどの物質が含まれていない、ルシフェラーゼのみの構造であったことから、発光メカニズムに関してはほとんど何もわかっていませんでした。
また、この黄緑色の発光を橙色や赤色に変えられることも、非常に興味深い現象として昔から知られていました。たとえば、ルシフェリンとルシフェラーゼを用いて発光反応を行う時に溶液を酸性にしたり、発光の手助けをするルシフェラーゼのアミノ酸残基※5を1つ変えたりすることにより、発光色が赤色に、劇的に変化します。しかしこの理由については、約40年間様々な研究が行われ、たくさんの理論が考えられてきましたが、はっきりしたことはわかっていませんでした。
2.研究手法
研究グループは、日本の代表的なホタルであるゲンジボタルのルシフェラーゼを用い、酸素の立体構造が発光反応の経過にともなって変化していくさまを連続写真のように順番に捕らえ、発光メカニズムを解明していく手法を考えました。すなわち、X線結晶構造解析の手法を用いて、原子レベルで酵素の連続写真を撮っていくというものです。
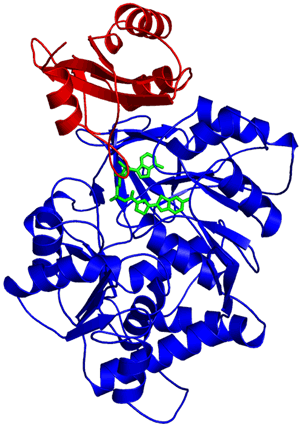
X線結晶構造解析を行うには、まずルシフェラーゼを高純度に精製し、品質の良い結晶を作る必要がありました。そこで、ゲンジボタルのルシフェラーゼの遺伝子を大腸菌に組み込み、大量に作らせるという遺伝子工学の手法を使いました。大腸菌に作らせたルシフェラーゼを高純度に精製したところ、非常に良好な結晶が得られました。また、反応の経過にともなって変化する酵素の構造を段階的に捕らえるために、(1)反応が始まる前、(2)発光の直前、(3)発光した後の3種類の状態を結晶中で作成し、その立体構造を決定しました。特に、今回の研究のポイントとなる(2)の発光反応直前の状態については、この構造に似た化合物(中間体アナログ)デヒドロルシフェリルスルファモイルアデノシン(DLSA、図1)を合成して用いたことで、この状態の結晶を初めて作成することに成功しました。さらに、大型放射光施設(SPring-8)によるきわめて高質なX線を用いることで、1.3 Å(オングストローム=10-10 m)分解能というきわめて高い分解能での構造解析(図2)が実現し、発光機構解明のカギとなりました。
3.研究成果
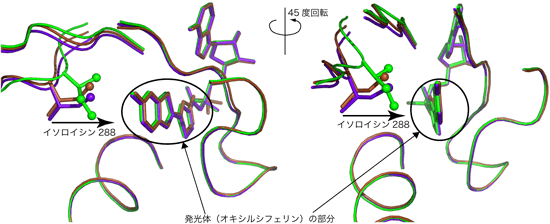
反応が始まる前、発光の直前、発光した後、の3つの反応段階のルシフェラーゼの立体構造について比較したところ、発光直前の構造では、ルシフェラーゼを構成しているアミノ酸残基のうち288番目のイソロイシン残基が発光体であるオキシルシフェリンのほうに大きく張り出すという特徴的な構造変化を起こしていることがわかりました(図3)。しかしこの構造変化は、発光を行うために必要なことなのか?黄緑色に光らせることに必要なことなのか?のどちらなのかはこの構造情報からだけではわかりませんでした。
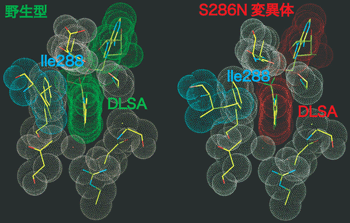
ところで、これまでの研究から286番目のセリン残基をアスパラギン残基に変えると発光色が黄緑色から赤色に変化することが知られています(図4)。そこで、この変異型ルシフェラーゼを使い、本来のルシフェラーゼ(野生型)と同じく、(2)の発光反応直前の立体構造を決定しました。すると、288番目のイソロイシン残基に特徴的な構造変化は観測されませんでした。このことから288番目のイソロイシンの動きは、赤色ではなく黄緑色に光らせるために必要な動きであることが示されました。
野生型のルシフェラーゼである黄緑色型、赤色に光らせる赤色型の2つの構造について、発光体であるオキシルシフェリンのまわりの環境(立体構造)を比較してみたところ、赤色型に比べて黄緑色型のほうが、オキシルシフェリンを非常に密に取り囲んでいる(しっかりと握っている)ことがわかりました(図5)。すなわち、黄緑色に光るためには、赤色に光るよりもより多くのエネルギーが必要であるため、288番目のイソロイシン残基は、オキシルシフェリンのもつ化学エネルギーを熱(振動)として無駄に逃がさないようにしっかり捕まえておくための「装置」として働いていることが予想されました。
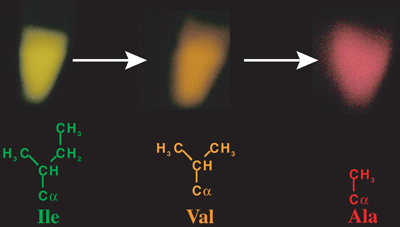
そこで、オキシルシフェリンを取り囲んでいる状態をわざと変化させるために、288番目のイソロイシンを、より小さなアミノ酸残基であるバリンやアラニンに変異させたルシフェラーゼを作成しました。その発光色を観察したところ、予想どおり、それぞれ橙色、赤色に発光し、よりエネルギーの低い色に変化していきました(図6)。すなわち、288番目のイソロイシン残基がオキシルシフェリンをしっかりつかまえておく「装置」として働いていることを、実験的に確かめることに成功したことになります。これは、288番目のイソロイシンというこれまで全く予期されていなかったアミノ酸残基を変化させることによって発光色の違う一連のルシフェラーゼを作成することによって、発光色の制御メカニズムを実験的に証明したことになります。
4.今後の期待
約100年前の1900年初頭には、「ホタルによる発光は発熱を伴わないため冷光である」との記載があり、1960年には、精密測定により、化学反応によって得られたエネルギーが発光のエネルギーに使われる変換効率(量子収率)は約9割であることが明らかにされました。この効率は、現在知られている発光システムの中でも最高の効率といえます。
今回明らかになった立体構造情報から、「なぜホタルの発光反応がこのように変換効率が良いのか?」ということがさらに明らかになれば、この一連の研究から省エネ型バイオナノマシン※6の開発などへの応用が期待できます。また、発光によるイメージング技術は、バイオ産業や医療など様々な分野での応用が進められており、今回の成果はさらなる波及効果をもたらすでしょう。さらに研究が進み、青色発光するルシフェラーゼを作ることができれば、光の3原色である赤、緑、青がそろうことになり、青色発光ダイオードが産業界に革命をもたらしたように、生物発光を利用したバイオイメージング等の分野でさらに応用が拡がることが期待できます。
<参考資料>
青色の大きなドメインと小さなドメインから構成されている。ルシフェリンの結合場所は両ドメインの間にある。緑色は発光直前の構造を模した反応中間体アナログDLSAの構造。1.3 Å分解能で構造解析された。
左図の向きを45度方向変えると右図になる。(1)反応が始まる前(茶色)、(2)発光の直前(黄緑色)、(3)発光した後(紫色)を比較すると、288番目のイソロイシン残基が発光体であるオキシルシフェリンの方に大きく張り出している。
ルシフェラーゼを構成するアミノ酸のうち、286番目のセリン残基をアスパラギン残基に変えると発光色が黄緑色から赤色に変化。
黄緑色型(野生型)と赤色型(286番目のセリン残基をアスパラギン残基にした変異体)のルシフェラーゼの発光直前状態。黄緑色型のほうがオキシルシフェリンをしっかり握るように近寄っていることがわかる。
残基の大きさが小さくなるにつれ、黄緑色、橙色、赤色に変化した。
<用語解説>
※1 ルシフェラーゼ
発光バクテリアやホタルなどの生物発光において、発光物質が光を放つ化学反応を触媒する作用を持つ酵素の総称。発光酵素とも呼ばれる。
※2 基質
酵素の触媒作用によって、化学反応が起こる物質。
※3 ルシフェリン
ルシフェラーゼによって酸化されて発光する様々な基質の総称。
※4 ATP
アデノシン3リン酸。生体内でエネルギー生産を行う過程で必ず使用される、非常に重要な物質。
※5 アミノ酸残基
タンパク質はアミノ酸が直鎖状に繋がってできおり、この直鎖にはもともとのアミノ酸の構造を示す小さな枝状の部分が存在する。この部分をアミノ酸残基という。
※6 バイオナノマシン
ナノマシンとは、ナノメートル(10-9 m)単位の機械装置を言い、生体物質がナノマシンのように振る舞うものをバイオナノマシンと呼ぶ。例えば、べん毛を形作るタンパク質は、タンパク質の集合がモーターのように働くことから、バイオナノマシンと言える。
|
<本研究に関する問い合わせ先> 独立行政法人理化学研究所播磨研究所 研究推進部 猿木 重文 (報道担当) <SPring-8についての問い合わせ先> (財)高輝度光科学研究センター |
- 現在の記事
- ゲンジボタルの発光現象の仕組みをとらえる(プレスリリース)