金属イオン・水・アミノ酸の架け橋は脂質を切るはさみ - 酵素「スフィンゴミエリナーゼ」の謎の反応機構を解明 -(プレスリリース)
- 公開日
- 2006年05月15日
- BL26B1(理研 構造ゲノムI)
- BL45XU(理研 構造生物学I)
平成18年5月15日
独立行政法人理化学研究所
徳島文理大学
本研究成果のポイント
● 触媒活性の異なる金属イオンが結合した酵素の複合体立体構造を解析
● 溶血を引き起こす細胞膜結合に「トリプトファン」などのアミノ酸が関与
● 美肌効果の高い化粧品などに貢献
|
独立行政法人理化学研究所(野依良治理事長)は、細胞膜を構成する複合脂質から、様々な細胞機能の調節に関与する脂質メディエータ※1を生産する「スフィンゴミエリナーゼ(SMase)」の立体構造を解明し、酵素反応に関する新しいメカニズムを提唱しました。これは、播磨研究所放射光科学総合研究センター宮野構造生物物理研究室の吾郷(あごう)日出夫先任研究員、宮野雅司主任研究員、徳島文理大学の小田真隆助手、津下(つげ)英明教授、櫻井純教授らによる成果です。 (論文) |
1.背 景
酵素活性を示すタンパク質である「スフィンゴミエリナーゼ」は、複合脂質の「スフィンゴミエリン」のリン酸エステル結合を加水分解して、生理活性を持つ脂質「脂質メディエータ」の「セラミド」と「フォスフォコリン※6」を産生します。また、アトピー性皮膚炎などに影響を与える皮膚のセラミドの含有を左右させる酵素としても知られています。その種類は、酵素活性を発揮する際の好ましい酸性度の違いや、必要な金属イオンの違いによって幾つかの種類に分類されています。その中で「マグネシウム依存中性スフィンゴミエリナーゼ(nSMase)」は、動物細胞からバクテリアまで広く存在が知られています。このnSMaseは、生物種に関わらず中性付近の酸性度の環境下で、マグネシウムの存在に依存して、スフィンゴミエリンからセラミドとフォスフォコリンを生産する性質を共有しています。また、この酵素反応に重要と考えられるアミノ酸も良く似ています。
食中毒菌として知られている「セレウス菌(Bacillus cereus)」由来の「Bc-SMase」は、赤血球を破壊する溶血活性が特徴の一つです。その一方、脂質メディエータ産生酵素の動物細胞内在性nSMaseと同様にスフィンゴミエリンを加水分解してセラミドとフォスフォコリンを生産して、細胞の分化、老化、アポトーシスを引き起こします。このため、nSMaseのリン酸エステル加水分解活性の触媒メカニズムは、生物種を超えて共通であると考えられます。したがって、Bc-SMaseの触媒メカニズムの研究は、バクテリアにとどまらず動物細胞内のnSMaseの働きを解明する上で重要な情報を与えられると考えられてきました。
nSMaseは、既に四半世紀の研究の歴史があり、好ましい酸性度や必要な金属イオンの種類などが明らかになっています。しかし、リン酸エステル加水分解活性に対する金属イオンの役割や、高い酵素反応を示すため特定の種類の金属イオンが必要な理由など、触媒メカニズムの詳細は未解明のままでした。また。Bc-SMaseを含むバクテリア由来のこの種の酵素に特徴的な溶血活性は、酵素の細胞膜への結合が必須条件ですが、これがどのようにして起こるのか、についても良くわかっていませんでした。
2.研究手法
研究グループは、金属イオンの役割を始めとするBc-SMaseのリン酸エステル加水分解活性の詳細を原子レベルで明らかにするために、活性を大きく高めることが知られているマグネシウムイオンとコバルトイオン、わずかに高めることが知られているカルシウムイオンのそれぞれが結合した三種類のBc-SMaseの結晶を作り、X線結晶構造解析の手法を用いてその構造を明らかにしました。大型放射光施設(SPring-8)の理研構造生物学IビームラインBL45XUと理研構造ゲノムIビームラインBL26B1を使って、これら三種類のBc-SMaseの立体構造を1.4〜1.8Å(オングストローム=10-10m)の精度で精密に決定したのです。さらに、酵素の膜結合に関わるアミノ酸を調べるために、得られたタンパク質の立体構造に基づいてデザインした変異型Bc-SMaseを作成し、その膜結合能や溶血活性を調べました。
3.研究成果
触媒活性を大きく高めるマグネシウムイオンとコバルトイオンは、Bc-SMaseの活性中心にあるグルタミン酸とヒスチジンの2つのアミノ酸のそれぞれに1個ずつ結合し、さらにその2個の金属イオンの間に、両方の金属イオンに結合する水分子1個が存在する構造でした(図1)。また、触媒活性をわずかしか高めないカルシウムイオンは、グルタミン酸にのみ結合している事が判明しました(図2)。このことから、Bc-SMaseが高い活性を発揮するためには2個の金属イオンが活性中心に結合する事が必要であるとわかりました。
さらに詳細に金属イオンの結合様式を検討した結果、金属イオンが結合するグルタミン酸とヒスチジンの2つのアミノ酸の間の距離が、結合する金属イオンの数を決めている事も明らかとなりました。すなわち、マグネシウムイオンやコバルトイオンが、水分子1個を間に挟んだ構造をとると、2個のイオン間の距離が、グルタミン酸とヒスチジンの2つのアミノ酸の間の距離とほとんど同じとなり、それぞれのアミノ酸に同時に金属イオンが結合する事が出来ます。しかし、カルシウムイオンは、マグネシウムイオンやコバルトイオンに比べて0.03 nm(ナノメートル。10-9 m)大きいため、2つのアミノ酸に同時に結合する事が出来ないのです(図3)。従来、「グルタミン酸だけが活性に不可欠な金属イオンと結合する」と考えられてきましたが、この考えに基づくと、酵素活性を大きく高める金属イオンと、あまり高めない金属イオンがあることを説明出来ませんでした。今回、「水分子を間に挟んだ2つの金属イオンが同時に2つのアミノ酸に結合する」という新しい考え方を提唱することによって、この問題を簡単に説明する事が出来るようになりました。
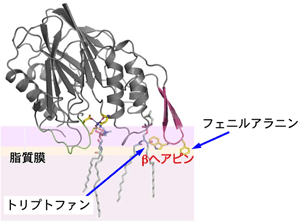
また、解析した構造情報から、Bc-SMaseから突き出たβ-ヘアピン構造※7に着目し、この構造の先端にある大きなアミノ酸「トリプトファン」及び「フェニルアラニン」を小さなアミノ酸である「アラニン」に置き換えた変異体を作成して性質を調べました。その結果、アラニンに置き換えた変異体Bc-SMaseの脂質膜結合能や溶血活性が著しく弱くなることがわかり、溶血活性を示すBc-SMaseの膜結合には、「トリプトファン」及び「フェニルアラニン」という2つの芳香族アミノ酸が重要な役割を果たしている事も明らかとなりました。これらの成果に基づいて作られた基質結合モデル(図4)と脂質二重膜結合モデル(図5)は、その反応機構と脂質膜への結合を、原子レベルでよく説明できます。
4.今後の期待
Bc-SMaseを含むnSMaseと同様に、リン酸エステルを加水分解する酵素の中にはBc-SMaseとアミノ酸配列上の類似性があり、さらに触媒反応に重要なアミノ酸もよく似ている一群があります。その一群は、代表的な酵素の名前をとって「DNase-I like folding superfamily※8」と呼ばれています。その中には、生体内で重要な情報伝達物質(であるイノシトールリン酸)の代謝に関わる酵素も含まれており、この酵素群は、生命機能において重要な役割を担っています。この酵素群に属するBc-SMaseで見いだした、1個の水分子を介する2個の金属イオンが活性中心に結合する新しい金属イオンの結合様式の新発見は、nSMaseを含む「DNase-I like folding superfamily」に属する酵素の働きを理解する事に大きく寄与することでしょう。
また、スフィンゴミエリンからSMaseにより生産されるセラミドは、皮膚の角質層に多く存在し、肌の健康に重要な働きを担っていることから、美肌効果の高い化粧品や、アトピー性皮膚炎の治療薬開発に繋がるものと考えられます。
<参考資料>
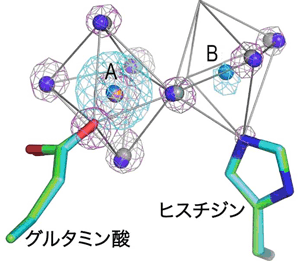 |
青色の球:コバルトイオン 黄色の球:マグネシウムイオン 紫色の球:コバルトイオンに結合した水分子 灰色の球:マグネシウムイオンに結合した水分子 水色のかごモデル:コバルトイオンの存在を示す電子密度 紫色のかごモデル:マグネシウムイオンとそれに結合している原子を表す電子密度 |
(A)のグルタミン酸へ結合したマグネシウムあるいはコバルトイオンは、結合水とともに金属イオンを中心とした正八面体構造を取っている。そのうちのひとつの水を共有したもう一つの(B)の位置の金属イオンの結合は離れやすいので電子密度が弱く、マグネシウムイオンのヒスチジンへの結合はマグネシウムとX線との相互作用が弱いことと相まって電子密度上には現れていない。その位置関係は、金属イオンを中心としたヒスチジンを含む八配位正八面体構造となっている。このヒスチジンに結合した金属イオンの動きやすさが酵素活性に重要と考えられる。
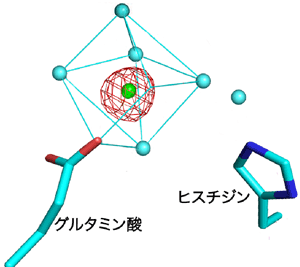 |
緑色の球:グルタミン酸のみと結合したカルシウムイオン 赤色のかごモデル:カルシウムイオンが結合していることを表す電子密度 水色の球:カルシウムイオンに結合した水分子 |
マグネシウムイオンやコバルトイオンと違い、カルシウムイオンは、グルタミン酸にのみ結合して七配位八面体構造をしている。
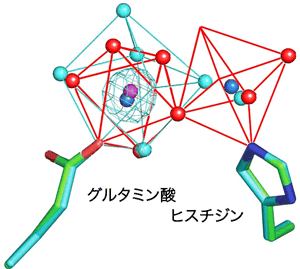 |
青色の球:グルタミン酸とヒスチジンそれぞれに結合したコバルトイオン 紫色の球:グルタミン酸のみと結合したカルシウムイオン 水色のかごモデル:カルシウムイオンが結合していることを表す電子密度 赤色の球:コバルトイオンに結合した水分子 水色の球:カルシウムイオンの周りにある水分子 |
マグネシウムイオンやコバルトイオンと違い、カルシウムイオンは、グルタミン酸にのみ結合している。カルシウムイオンに結合した水分子が作る八面体の大きさは、コバルトイオンに結合した水分子が作る正八面体より大きく、カルシウムに結合した水分子の一つが、ヒスチジンの近傍に存在し、ヒスチジンにカルシウムイオンがもう一つ結合する事は難しい。
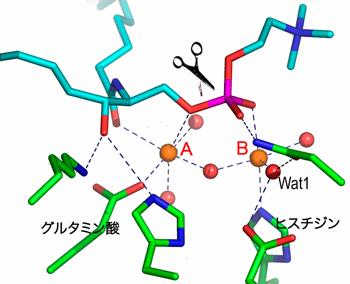 |
橙色:活性型金属イオン 赤色:酸素 紫色:リン 緑:アミノ酸残基の炭素骨格 水色:スフィンゴミエリンの炭素骨格 |
二つの活性型金属イオンA,Bが水をはさんだ形でアミノ酸に結合している(水素は表示していない)。はさみのところでリン酸エステル結合は切断される。活性化された水Wat1が塩基としてリン酸を攻撃する。
赤い部分が脂質結合に必須なβヘアピン構造。Bc-SMaseから突き出たβヘアピンにあるアミノ酸「トリプトファン」及び「フェニルアラニン」が溶血活性を示すBc-SMaseの膜結合に重要であることがわかった。
<用語解説>
※1 脂質メディエータ
生理活性脂質のうち、生体内で生産され、その受容体を介して生体機能を変換する脂質。反応などを仲介、伝達しているように見えることからメディエータの名が付いた。
※2 リン酸エステル結合
リン酸一分子とアルコール一分子が脱水縮合して出来る結合。
※3 加水分解
脱水縮合して出来た結合に水一分子を付加することで、その結合を切断する反応。
※4 アポトーシス
生物の体をより良い状態に保つために引き起こされる細胞の自殺のこと。一方、血行不良、外傷などによる細胞死は、ネクローシスと呼ばれる。
※5 大型放射光施設(SPring-8)
兵庫県にある大型共用施設。高速で進む高エネルギー状態の電子を加速すると電磁波が発生する。とくに、偏向電磁石の中では、電子は円軌道上を運動し、運動の接線方向に強い電磁波を放出する。これが「放射光(シンクロトロン放射)」と呼ばれるもの。特に大型放射光施設と呼ばれるものには、世界にSPring-8、APS(アメリカ)、ESRF(フランス)の三つがある。SPring-8(電子エネルギー:8GeV)の場合、遠赤外から真空紫外、軟X線、X線を経てガンマ線に至る幅広い波長域で放射光を得ることができ、国内外の研究者の共同利用施設として、物質科学・地球科学・生命科学・環境科学・産業利用などの分野で利用されている。
※6 フォスフォコリン
フォスフォは、リン酸を示す接頭語。コリンは体内でアミノ酸から作られる、水溶性のビタミン様物質で、人体の中では、アセチルコリンの形で神経の働きを助ける役割を持つ。
※7 β-ヘアピン構造
タンパク質内で見られる二次構造のうち、同じ向きや逆方向に、伸びた構造のポリペプチド鎖が2本以上何本か並んで作られる平面状の構造をβシート構造と呼ぶ。ポリペプチド鎖がヘアピンの先端の折り返しと同じように急に方向転換して逆向きのβシートを形成した構造をβヘアピン構造と呼ぶ。
※8 DNase-I like folding superfamily
DNAを切断する活性を持つDNase-Iと相同な立体構造を持つタンパク質のグループの名称。
|
<本研究に関する問い合わせ先> 独立行政法人理化学研究所 播磨研究推進部 猿木 重文 徳島文理大学 健康科学研究所 生体分子構造学部門 (報道担当) <SPring-8についての問い合わせ先> (財)高輝度光科学研究センター |
- 現在の記事
- 金属イオン・水・アミノ酸の架け橋は脂質を切るはさみ - 酵素「スフィンゴミエリナーゼ」の謎の反応機構を解明 -(プレスリリース)