細胞の発生・増殖・分化などを制御するタンパク質の構造と機能を解明 - 大腸ガンや肝臓ガンなどの発生メカニズムの基礎研究 - (プレスリリース)
- 公開日
- 2007年05月28日
- BL41XU(構造生物学I)
平成19年5月28日
公立大学法人兵庫県立大学
国立大学法人広島大学
独立行政法人理化学研究所
財団法人高輝度光科学研究センター
本研究成果のポイント
○ 細胞の分化・増殖に関与するWnt(ウィント)シグナル伝達経路(Wnt3) ※1で働くDishevelled(ディシブルド、略称Dvl2)というタンパク質が、そのDIXドメインと呼ばれる部分で「可逆的に多量体(高分子)化※2」し、それがこのDvl2タンパク質の働きに重要であることを発見。
○ Wntシグナル伝達経路で重要な働きを持つ、Axin(アキシン)分子のDIXドメインのX線結晶解析に世界で初めて成功。
○ DIXドメインはユビキチン※3構造を持ち、分子が一列に並んで多量体化する構造「βストランド※4の相互作用によるhead-to-tail型構造※5」であることを発見。
○ DIXドメインの構造に基づいて作成した変異体※6を使った実験によりDvl2の多量体化のメカニズムを実証。
○ DIXドメインに見られるような分子同士の「可逆的な多量体化」のしくみは他のシグナル伝達においても利用されている「普遍的な原理」である可能性を提案。
|
公立大学法人兵庫県立大学(熊谷信昭学長)、国立大学法人広島大学(浅原利正学長)および英国Medical Research Councilは共同で、Wnt(ウィント)シグナル伝達経路で働くAxin(アキシン)とDishevelled(Dvl2=ディシブルド)のDIXドメインの細胞内機能とその結晶構造を解明しました。これは、兵庫県立大学大学院生命理学研究科の樋口芳樹教授、柴田直樹准教授、広島大学大学院医歯薬学総合研究科の菊池章教授、独立行政法人理化学研究所(野依良治理事長)、財団法人高輝度光科学研究センター(吉良爽理事長)および英国Medical Research CouncilのMariann Bienz博士らの共同研究グループによる成果です。 (論文) |
1.背 景
Wnt(ウィント)※1は分泌性の細胞間シグナル伝達タンパク質で、線虫やショウジョウバエからヒトに至るまで生物種を越えて保存されていることが知られています。Wntにより制御される細胞内シグナル伝達経路も種を超えて保存されており、本シグナル伝達経路は細胞の増殖や分化、運動、初期胚発生時の体軸形成や器官形成などの重要な生物学的機能を制御しています。さらに、種々のヒト疾患でWntシグナル伝達経路の構成タンパク質の遺伝子異常が見出されており、本シグナル伝達経路はこれらの関連する疾患の治療のためにも基礎生物学的・臨床医学的に注目を集めていました。Wntの細胞内シグナル伝達機構は複数のタンパク質複合体により制御されていることが明らかになっています。本研究グループでは、Wntシグナル伝達経路の構成タンパク質であるAxin(アキシン)およびDishevelled(Dvl2=ディシブルド)の研究を展開してきました。
Wntにより細胞が刺激されると、β-カテニン※1というタンパク質が安定化されて細胞内に蓄積し、核内に移行します。その後、遺伝子に作用して細胞の増殖や分化を制御することになります。このβ-カテニンが関係する経路ではDvl2分子はβ-カテニンを安定化する役割を持ちます。一方、Axinは他のいくつかのタンパク質と協同でβ-カテニンに作用し、最終的にはβ-カテニンを不安定化させて分解に導きます。すなわち、Dvl2とAxinによりβ-カテニンの細胞内の量が制御され、これにより細胞の増殖や分化が制御されているのです。
このように「Wntシグナル伝達系で働くタンパク質が、細胞内でどのように関係し合い、また、どのようなしくみでβ-カテニンの量を調節しているのか?」に関する研究はこれまで本研究グループが大きな貢献をして多くのことを明らかにしてきました。しかし、Axin分子とDvl2分子がともに持っているDIXドメインと呼ばれる部分の構造は不明で、その働きもはっきり解明されていませんでした。
2.研究手法と結果
研究グループでは、Dvl2の野生型※6とDIXドメインを取り去った人工変異体※6の細胞内での様子を観察しました。その結果、野生型のDvl2は細胞内で濃度に比例して多量体化(多くのDvl2分子が集合して固まりを作る)して点状に分布していました。このDvl2の多量体化は可逆的(固まりが生じたり、なくなったりする)であり、この可逆的な性質を失ったある種類のDvl2変異体は、Wntシグナル伝達経路で正常に働かないことが分かりました。また、 DIXドメインを切り取ってしまったDvl2も、細胞内で多量体化することができず、正常に働かないことも分かりました。そこでDIXドメインによるDvl2の「可逆的な多量体化」のメカニズムを解明するために、その立体構造を調べることにしました。
まず、Dvl2とAxin分子中のDIXドメインのみを切り出して結晶化を試みました。DIXドメインは細胞外に抽出すると多量体化して沈殿し、また簡単に壊れやすいタンパク質でした。本研究グループは、いろいろな試行錯誤の末、AxinのDIXドメインを結晶化することに成功しました。その結果、X線結晶構造解析の手法を用いてAxinのDIXドメイン分子の立体構造を2.8 Å分解能※8で、世界で初めて決定しました。X線回折データの取得は大型放射光施設(SPring-8)※9の構造生物学IビームラインBL41XUのを利用しました。
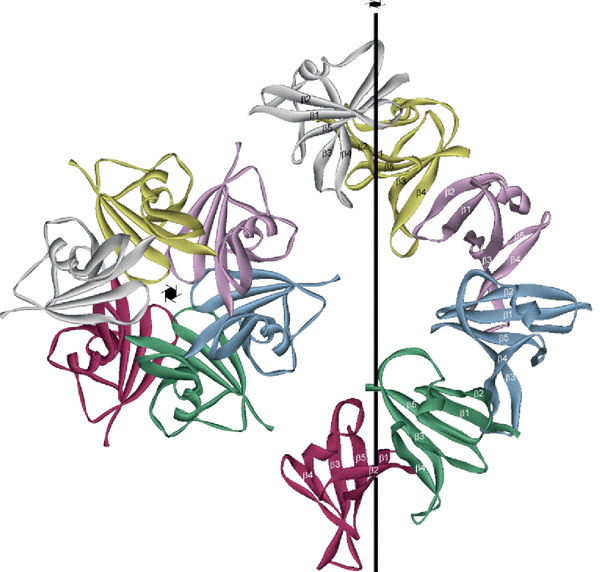
AxinのDIXドメインはユビキチンというタンパク質と同様のβシート構造から成る構造(ユビキチン様構造と呼ばれる)を持っていました。また、DIXドメイン分子は、結晶内の隣り合う分子のそれぞれのシート構造の両端にあるβストランドがつながって無限に多量体化していることを見出しました(多くの分子一列に並んで、まるで一枚のシートのようになる。図1参照)。この特徴的な分子の集合体の様式をβストランドによる「分子間β2-β4相互作用」による「head-to-tail型構造」)と命名しました。この相互作用が前述のDIXドメインの「可逆的な多量体化」を可能にしていると考えました。(注意: この多量体化の様子は、細胞内で不要になったタンパク質を分解するときに、タグとして結合するユビキチン本来の多量体化「ポリユビキチン」の様子とは全く異なります)
さらに、立体構造から得られた知見を元にDIXドメインのβ2およびβ4のストランド(隣り合う分子同士でお互いにつながる)にあるアミノ酸残基を人工的に変えた変異体をつくり、細胞内での様子と働きを調べました。その結果、この人工変異体は細胞内でも多量化することができず、また正常には働きませんでした。つまり、Dvl2が正常に働くためにはDIXドメインのβ2およびβ4のストランドにある重要なアミノ酸によって「分子間β2-β4相互作用」をして、その結果、Dvl2が細胞内で「可逆的に多量体化」することが必須であることを証明することができました。
最近、細胞内の他の重要なシステムで働くタンパク質で、Dvl2と同様に多量体化するものが見つかってきています。上記の研究で得られた知見より、DIXドメインによるDvl2の「可逆的な多量体化」による細胞内での働きは、他の重要なシステムにおいても利用されている普遍的な原理である可能性を提案しました。
3.今後の展開
今後は、DIXドメインの立体構造をもとに分子を設計・合成してAxinおよびDvlの細胞内での働きをコントロールできるようになるかもしれません。また、本研究を契機にDvl2やAxinの「可逆的な多量体化」がどのようなしくみで細胞の分化や増殖を制御しているのかが解明されていくことと思われます。さらに、本研究成果は、大腸がんや肝臓がん等の病気の治療や新薬開発に重要な知見を与えるものと期待されています。
<参考資料>
6回ラセン軸方向から見た図(左)とラセン軸の垂直方向から見た図(右)。Dvl2やAxinはこのDIXドメインがβ2-β4相互作用をしてhead-to-tail型構造で可逆的に多量体化できると考えられる。
<用語解説>
※1 Wntシグナル伝達経路、Wnt、β-カテニン
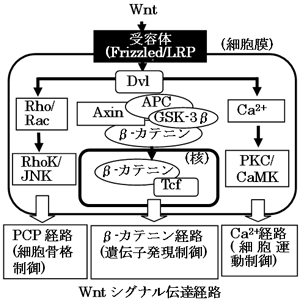
Wnt(ウィント)は細胞外リガンド(結合因子)として機能する分泌性のタンパク質であり、線虫やショウジョウバエからヒトに至るまで生物種を越えて保存されている。ショウジョウバエにおけるWnt (wingless=ウィングレス) の変異の表現型は幼虫における分節異常や成虫における翅の欠如である。哺乳動物においては19種類のWntが存在し、ノックアウトマウスの解析によりWntは発生初期における体軸形成や器官形成に必須であることが明らかになっている。また、Wnt1はマウス乳がんにおいて、ウィルスにより発現誘導される遺伝子として同定されたがん遺伝子でもある。このように、Wntは遺伝学や発生生物学・腫瘍学という異なる領域において、生物学的に重要なタンパク質として位置付けられるようになった。Wntが細胞膜上の受容体に結合した後に活性化される細胞内のシグナル伝達機構には、(1)β-カテニン経路、(2)平面内細胞極性 (PCP) 経路、および(3)Ca2+経路の3種類が存在する(下図)。本研究は、β-カテニン経路のDvl2とAxinについて行われた。
※2 可逆的な多量体(高分子)化
本論文でいう「可逆的な多量体化」とは、多くのディシブルドタンパク質が細胞内で集まってきて結合したり、離れたりすることを繰り返している現象を指す。
※3 ユビキチン
タンパク質の翻訳後修飾の一種で、76個のアミノ酸からなるユビキチンのカルボキシル末端が、別のタンパク質のリジン※10残基側鎖のアミノ基とイソペプチド結合により枝分かれ状に結合したものを呼ぶ。ユビキチンが1分子だけ結合する場合(モノユビキチン化)と、ユビキチンにさらにユビキチンが結合することによって鎖状に伸長する場合(ポリユビキチン化)がある。
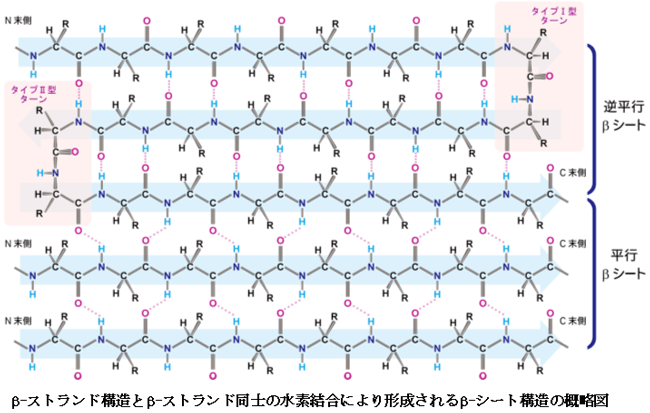
※4 β-ストランド、βシート構造
タンパク質の立体構造に頻繁に見られる部分構造で、ペプチド結合でつながったアミノ酸が伸び切った状態をいう。立体構造上隣り合うβ-ストランドは、水素結合という弱い結合で相互作用し、一枚の平面シート構造(これをβシート構造という)を作りやすい(下図参照)。
※5 head-to-tail構造、β2-β4相互作用
本論文では、DIXドメインのシート型構造の両端に位置する2つのβストランド(β2とβ4)をそれぞれhead(β2)とtail(β4)と呼ぶ。分子が一列に並んでβ2とβ4が相互作用し(β2-β4相互作用)、無限に分子が並んでいる様子をhead-to-tail構造と名づけた。
※6 野生型と変異体
タンパク質のある特定のアミノ酸が他のアミノ酸に入れかわったものを「変異体」言う。人為的にアミノ酸を入れ換えたものを特に「人口変異体」という。また、生物がもともと持っているタンパク質を「野生型」という。本論文ではDIXドメインの機能に重要であると思われたアミノ酸(766番目のチロシン※11、806番目のバリン※12、807番目のフェニルアラニン※13など)をアラニン※14に変異させてDIXの働き、最終的にはDvl2の働きに影響が出るかどうかを調べた。
※7 システイン
タンパク質を構成する20種類のアミノ酸の一つで、CysあるいはCの略語で表される。側鎖にイオウ原子を含むチオール基(-SH 基)を持ち、2 個のシステインのチオール基のイオウ原子同士が結合(ジスルフィド結合)をするとペプチド鎖に架橋を生じる。
※8 分解能
X線結晶解析でタンパク質などの立体構造を決めたとき、その解析の精度を表すひとつの指標。本研究解析したDIXドメインの2.8 Å分解能では、分子構造がはっきりと決定できていることを示す。タンパク質の場合、一般的には1.5〜3.0 Å分解能で解析される。
※9 大型放射光施設(SPring-8)
兵庫県にある大型共同利用施設。ほぼ光速で進む電子が、その進行方向を磁石などによって変えられると接線方向に赤外線や可視光線、紫外線やX線などを含む電磁波が発生する。これが放射光であり、電子のエネルギーが高く、進行方向の変化が大きいほど、X線などの短い波長を含むようになる。第三世代の大型放射光施設と呼ばれるものには、世界にSPring-8、APS(アメリカ)、ESRF(フランス)の3つがある。
※10 リジン
タンパク質を構成する20種類のアミノ酸の一つで、塩基性極性アミノ酸に分類されるアミノ酸である。LysあるいはKの略語で表される。側鎖の端に窒素原子を持つ。
※11 チロシン
タンパク質を構成する20種類のアミノ酸の一つで、側鎖に芳香族のフェノール基を持つ。 TyrあるいはYの略語で表される。
※12 バリン
タンパク質を構成する20種類のアミノ酸の一つで、側鎖に疎水性のイソプロピル基を持つ。ValあるいはVの略語で表される。
※13 フェニルアラニン
タンパク質を構成する20種類のアミノ酸の一つで、側鎖に疎水性芳香族のベンジル基を持つ。 PheあるいはFの略語で表される。
※14 アラニン
タンパク質を構成する20種類のアミノ酸の一つで、側鎖にメチル基をもち、疎水性アミノ酸に分類される。AlaあるいはAの略語で表される。
|
<お問い合わせ先> (研究に関すること) 広島大学 大学院医歯薬学総合研究科 (ビームラインに関すること) (理化学研究所に関すること) (SPring-8に関すること) |
- 現在の記事
- 細胞の発生・増殖・分化などを制御するタンパク質の構造と機能を解明 - 大腸ガンや肝臓ガンなどの発生メカニズムの基礎研究 - (プレスリリース)