細胞表面に存在するイオンの通り道の動きを1分子で観測!- 世界初、SPring-8 でチャネル分子内部の構造変化を実時間検出 -(プレスリリース)
- 公開日
- 2008年01月11日
- BL44B2(理研 物質科学)
平成20年1月9日
科学技術振興機構(JST)
財団法人 高輝度光科学研究センター
国立大学法人 福井大学
|
JST(理事長 北澤宏一)と(財)高輝度光科学研究センター(理事長 吉良爽)、福井大学(学長 福田優)は、細胞を出入りするイオンの通り道であるイオンチャネル分子*1が、分子の中心を貫く穴をどのようにして開閉するか、その動作を1分子ごとにビデオ記録することに成功しました。 |
1. 研究の背景と経緯
細胞の表面には、細胞膜を貫通するイオンチャネル分子というたんぱく質が存在します。このチャネル分子を貫く穴を通って、イオンは細胞の内外を通過することができます。特定のイオンを通すチャネル分子が多種類、生体には存在します。チャネル分子は、さまざまな刺激を感じてイオンの流れをスイッチし、流したり遮断したりします。たとえば細胞外に特定の物質があると穴を開いてイオンを流し、これによって細胞内で情報を処理したり、隣の細胞に伝えたりできます。特に神経や心臓では、情報を速くかつ遠くまで伝えていますが、これはチャネル分子の働きなしに実現できません。実際、心電図や脳波は、細胞膜上で働いているチャネル分子の活動を観察しているのです。たとえば心電図で不整脈が診断できますが、それはチャネル分子の働きの異常を診断していることになるのです。
チャネル分子の一種であるカリウムチャネル分子は、カリウムイオン(K+)だけを選択的に通す分子で、これはバクテリアからヒトの細胞に至るまで広く存在します。すなわち、すべての細胞はカリウムイオンを細胞内外でやりとりする必要があるのです。カリウムチャネル分子はカリウムイオンだけを高速で流すことができ、また何らかの刺激を受け取りカリウムイオンの流れをスイッチすることができる、という共通の性質を持っています。進化の初期から数十億年にもわたって生物が使い続けてきたカリウムチャネル分子は、生物にとって最も基本的なたんぱく質分子のひとつと言えます。
カリウムチャネル分子がどのような形を持った分子で、イオンを通す穴はどのような構造か、またその穴を開閉するのはどのような機構か――これがカリウムチャネルという優れたナノマシーンを解明するための最も本質的な課題でした。この課題に向かって長年多くの研究が積み重ねられてきましたが、この中で2つの大きなブレークスルーが現在までありました。第一のブレークスルーはチャネル分子の電気特性を1分子ごとに観察することができるようになったことです。小さな細胞といえども、その細胞膜の上にはチャネル分子が数十万個存在し、それぞれが独立に働いています。たった1分子のチャネルだけを隔離し、その働いている電気的特性を計測できるような実験方法が開発されたのです(Neher & Sakmann、1991 年ノーベル医学生理学賞)。そして、第2のブレークスルーはカリウムチャネル分子の形、すなわち立体構造が明らかになったことです(MacKinnon、2003 年ノーベル化学賞)。生体膜中のたんぱく質分子の立体構造を決めることは特に難しいとされており、実際、現在までに立体構造が明らかになった膜たんぱく質は数えるほどしかありません。この困難を乗り越えた成果により、チャネル分子としては初めてその立体構造の全容が明らかになりました。この構造決定以来、チャネル研究は世界中でしのぎをけずってきました。このような状況下において、本研究グループは、佐々木により開発された1分子が動く様子を高精度にかつ実時間で測定できる革新的な手法、X線1分子追跡法*3を用いて、「チャネル分子が静止している状態で得られた立体構造、つまりスナップ写真」ではなく、「分子が働いている正にその状態、すなわちチャネル分子が働くために構造を変化させつつあるその現場を捉えたビデオ映像」を得ることにより、沢山のチャネル分子からの平均的な情報では得ることができなかった、1分子内のチャネルの構造が変わりつつある現場を捉えることに挑戦したのです。
2. 研究の内容
スナップ写真として見えた、つまり静止画としてのカリウムチャネル分子の構造が、イオンの流れを制御するために開閉する際、分子のどの部分がどのような形の変化をすれば機能を生み出せるのか――これを佐々木が開発したX線1分子追跡法で、1分子のチャネル分子が変化する様子を実時間で高精度に動画として観察することに成功しました。
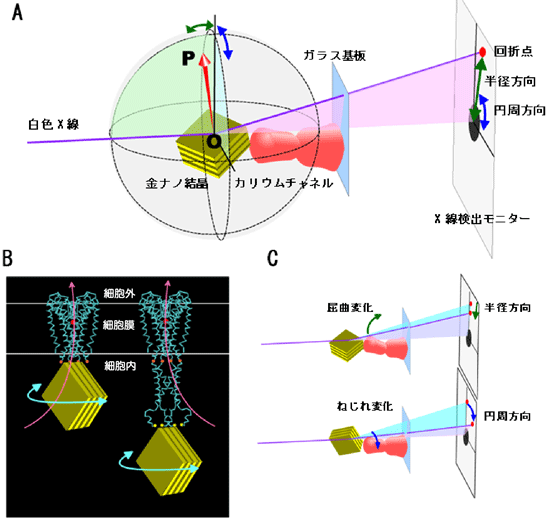
カリウムチャネル分子は、分子の中央にイオン透過路(穴)があり、イオンの流れを遮断する状態では、細胞内側の入口でイオン透過路が閉じています(図1B、図2)。この閉じている入口部分が開閉に伴って動くと考えられていました。本研究においては、チャネルの開閉部位を直接観測するために、丸ごとの分子と細胞内領域を切り取った分子の2種類を使用してどの部分から運動が発生しているかを調べました(図1B)。分子の動きを観測するため、次のような方法をとりました。まずカリウムチャネル分子を細胞外側でガラス基板に固定し(図1A、図2緑色丸)、次に細胞内側に金ナノ結晶*4(20nm, 1mmの5万分の1程度)を結合します(図1、図2の橙色丸)。チャネル分子は水で取り囲まれているので、分子の一端は基板に固定されていても、金ナノ結晶をつけた他端は揺らぐことのできる状態にあります。
高輝度白色X線*5(SPring-8, 理研構造生物学IIビームライン BL44B2)をガラス基板に当てると(図1)、金ナノ結晶からの回折点(輝点)のみをX線計測モニター上で高精度に観測することができます。輝点がX線計測モニター上のどの位置で観測されるかは、金ナノ結晶の回折面が向いている方向によって決まります(図1A 中矢印OP)。すなわち金ナノ結晶が動くと輝点がX線モニター上で動きます。あたかもナノサイズの小さな鏡に光を当てて、その光の反射される先を観測しているかのように金ナノ結晶の回折面と輝点は関連して動きます。金ナノ結晶はカリウムチャネル分子に結合されているので、カリウムチャネルが構造を変えれば、X線計測モニター上で輝点の運動として観測することができるのです。チャネルの形の屈曲変化はX線モニター上で輝点の半径方向の運動として観測され、ねじれ変化は円周方向の運動として観測されます(図1C)。
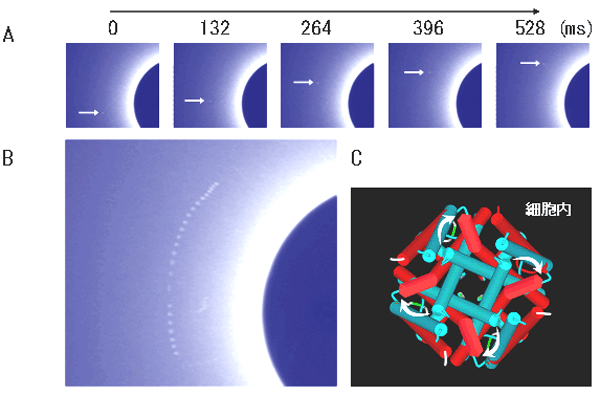
観測した結果、カリウムチャネル分子が閉じた状態での輝点の運動を観察すると、狭い範囲で半径方向の運動のみが観測されました。これはチャネル分子がランダムにわずかに屈曲していることを表していました。ところが、開閉を繰り返す条件で実験を行うと、チャネル分子が大きくねじれていく運動が見えたのです(参考図3A,B)。金ナノ結晶はチャネル分子の細胞内側入口に結合しているので、このねじれ運動は、イオン透過路が閉じた形(図3C 青が閉構造モデル)から開くときの構造変化の過程を捉えたことになります。また、開いた形(図3C 赤が開構造モデル)から閉じるときに起きる逆向きの構造変化の過程も同様に捉えることに成功しました。このようにチャネル分子の構造がねじれ変化を起こすことで、細胞内側の入口で分子中央の穴が絞られたり、広がったりしてイオン透過が制御されている様子が初めて明らかになったのです。また、このカリウムチャネル分子には、細胞内に突き出た比較的大きな部分構造(細胞質領域)があります(図1B右図)。図1B左図のようにこの領域を切り取らず、細胞質領域の末端に金ナノ結晶を結合して、チャネル分子が開閉する条件下でも観測しました(図1B右の黄色丸)。その結果、切り取った場合とほぼ同様なねじれ変化を観測しました。この新しい運動である分子のねじれが分子の細胞質領域側の末端まで伝達されていることが確認できたのです。
チャネルたんぱく質分子が関与する疾患において、臨床ではチャネル阻害薬というものがよく使われます。神経細胞に作用する局所麻酔薬もその一種で、チャネル分子の穴をふさいでイオンの流れを遮断するものです。これらの薬物分子はイオンの通る穴の深いところに到達することが知られていました(図1Bの赤色丸)。このチャネル阻害薬の存在下でチャネルの構造変化を見たところ、チャネル分子のねじれは止まってしまいました。チャネル阻害薬はイオンの流れを遮断するだけでなく、チャネル分子の構造を固定してしまうということが明らかになりました。チャネル阻害薬は穴に結合しているのですが、丸ごとの分子も細胞内領域を切り取った分子も、いずれも動きが止まり、構造が固定されることが分かりました。このことはチャネル分子の構造変化が穴の付近を起源として起こり、これが細胞内領域にも伝わっていることが分かりました。
|
図1 測定の概略図
|
|
| A: | ガラス基板に固定したチャネル分子に金ナノ結晶をつける。これにX線を照射すると、金ナノ結晶からの回折点がX線モニター上で観測される。矢印OPは金結晶のX線回折面の向き。 |
| B: | カリウムチャネルの動きを2箇所で観測。チャネルの開閉部位を直接観測するために、丸ごとの分子と細胞内領域を切り取った分子の2種類の分子を使用してどの部分から運動が発生しているかを調べた。チャネルの細胞内側に金ナノ結晶をつけたが、細胞膜直下(左)と細胞内側先端(右)の2箇所で動きを観測した。赤色丸はチャネル阻害剤が結合する部位。橙色丸と黄色丸は金ナノ結晶との結合位置。 |
| C: | チャネルの構造変化と回折点の動きの相関。チャネルが屈曲すると半径方向に、ねじれると円周方向に回折点が動く。 |
|
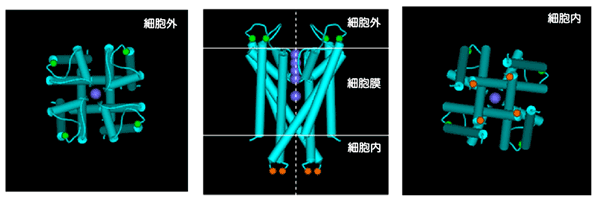
図2 カリウムチャネル(KcsA チャネル*6)の立体構造
|
|
| 中央図: | 中央(白点線)のイオン透過路に沿ってイオンは流れる。紫色丸はカリウムイオン。緑色丸はガラス基板への固定箇所、橙色丸は金ナノ結晶の固定位置。閉状態の立体構造。 |
| 左 図: | 細胞外側から見たチャネル。分子中央にイオン透過路があるのが分かる。イオンは脱水和して透過路に入る。 |
| 右 図: | 細胞内側から見た構造。一見イオンが通りそうに見えるが、細胞内側ではイオンは水和した状態であるため通過できないことが分かっている。 |
|
図3カリウムチャネルのねじれ構造変化
|
|
| A: | 回折点の動きを撮影した連続画像。実際の撮影は33ms 間隔。抜粋して表示。 |
| B: | 回折点の軌跡。24 枚、759ms の画像を重ねた画像。右の青円が図1A のX線モニター中央黒丸に相当。回折点の回転運動はチャネル分子のねじれを意味する。 |
| C: | 細胞内側から見た開閉に伴うチャネルの構造変化。青(閉構造)から赤(モデル)へと変化することによって中央のイオン透過路が開く。この円周方向の回折点の動きを分子のねじれ運動として実時間で観測することに成功した。 |
3. 今後の展開
私達は長年議論されてきたチャネルたんぱく質分子の開閉に伴う構造変化を世界に先駆けて実時間高精度計測することに成功しました。この成果はチャネル研究史において、1分子構造変化観測という極めて大きな足跡を残したと言えるでしょう。今回の論文で発表すること以外にも、数種類の新しい現象を発見しました。これらのデータの中に隠されたチャネル分子の構造変化の秘密を解き明かすことが次の課題です。今後、X線1分子追跡法実験の継続的な研究はもとより、分子内ねじれ構造変化の全体像の把握、高速(マイクロ秒)領域における運動挙動解析など、全く未知の領域にも研究展開をしなければならないと考えています。また、チャネル分子の開閉における運動途中における構造に対する創薬という観点から、薬理学的にも臨床的にも応用展開することを視野に入れて研究を進めていきます。つまり、現在行われている創薬では静止した状態に対するチャネル分子への戦略を立てて来ましたが、これからは分子の運動を考慮した新しい創薬コンセプトを得ることができるのです。
私達のさらなる目標は、イオンチャネルの機能と構造変化を1分子同時計測することです。大型放射光施設という大電流が飛び交う環境の中で、1分子を通る微弱な電流を測定することにはすでに成功しています。もう少しで多くのチャネルたんぱく質分子への応用が可能な段階にまできています。細胞上で1分子のチャネルたんぱく質分子から電流値と構造変化をマイクロ秒の速さで実時間追跡できるのも、それほど遠い将来ではありません。幸い本計測手法であるX線1分子追跡法は平成18年から5年間、SPring-8戦略的重点研究課題の指定を受けることができました。また同年から5年間JST/CREST(研究領域“生命現象の解明と応用に資する新しい計測分析基盤技術”研究総括 柳田敏雄 大阪大学教授、研究題名 高精度1分子内動画計測から見える生体分子構造認識プロセス、研究代表 佐々木裕次)として新たに研究課題が採択されました。同時に昨年11月にX線1分子追跡法を考案した佐々木裕次(研究代表者)は平成19年度の第21回日本IBM科学賞(物理部門)を受賞しました。これは本研究全体の方向性が高く評価されたことによるものです。
<用語解説>
※1 イオンチャネル分子
細胞膜中に存在し、細胞内外のイオン濃度勾配にしたがって特定のイオンを選択して通す機能をもつたんぱく質。細胞内外の環境変化を受容するセンサーの役割を持つ。種々の化学物質、細胞膜の電気特性等によって開閉が制御されている。
※2 チャネル病
イオンチャネルたんぱく質の変異、チャネルに対する抗体などに原因を持つ疾患の総称である。例えば、若年者の運動中の心臓マヒ、睡眠中に原因不明で亡くなるポックリ病、乳児突然死症候群などは心臓チャネル病(家族性不整脈)です。また、てんかんの原因遺伝子として多くのイオンチャネル異常が現在まで発見されています。
※3 X 線1分子追跡法
佐々木が考案した1分子ダイナミクス測定法。金ナノ結晶を対象に結合させ、対象の運動を金結晶からの回折点の運動として計測する1分子計測法。1 ミリラジアン(約0.06 度)以下の精度で運動を実時間検出できる。高輝度白色X線を用いることにより運動を広範囲に連続的に観測することが可能となった。試料からX線検出モニターまでの距離は10cm で今回は行った。
※4 金ナノ結晶
X線1分子計測法のために佐々木が作製法を開発した20 ナノメートル(1ナノメートルは1ミリメートルの100万分の1の長さ)の金微結晶。層状の結晶で、複数の回折点が観測される通常の3次元結晶とは異なり、1つの結晶から1-2つの回折点が観測される。同じナノ結晶からの回折斑点かどうかは、それぞれの斑点の運動を解析することで識別可能。
※5 高輝度白色X線
大型放射光施設(SPring-8)(理研構造生物学IIビームライン BL44B2)で、本実験では6-30 keV のエネルギーを持つX線を照射した。たんぱく質構造解析に使われる単色X線と異なり、多波長のX線を含むため白色X線と呼ぶ。広範囲の運動をモニターできたのは、この白色X線を使用したからである。
※6 KcsA チャネル
放線菌由来のカリウムイオンチャネル。初めて原子分解能の立体構造が明らかになったカリウムイオンチャネルで、細胞内のpHによって開閉が制御される。中性では閉状態。酸性で開閉運動をする。
<研究領域等>
戦略的創造研究推進事業 チーム型研究(CREST)
研究領域:たんぱく質の構造・機能と発現メカニズム
(研究総括:大島泰郎 共和化工株式会社 環境微生物学研究所 所長)
研究課題名:X線1分子計測からのin-vivo 蛋白質動的構造/機能解析
研究代表者:佐々木裕次(SPring-8/(財)高輝度光科学研究センター 主幹研究員)
研究期間:平成13年度~平成18年度
|
<問い合わせ先> (研究内容に関すること) 老木成稔(おいき しげとし) 瀬谷 元秀(せや もとひで) (SPring-8全般に関すること) |
- 現在の記事
- 細胞表面に存在するイオンの通り道の動きを1分子で観測!- 世界初、SPring-8 でチャネル分子内部の構造変化を実時間検出 -(プレスリリース)